- jsou to proteiny, které katalyzují chemické reakce v živých organismech
- jsou velice účinnými specifickými biokatalyzátory
- i v malých množstvích urchlí reakce i za nižších teplot
- katalyzují konkrétní typ reakce konkrétní látky
- krom proteinových enzymů existují i enzymy z nukleových kyselin
- ribozomy
Funkce enzymů
- snižují aktivační energii potřebnou k uskutečnění reakce
- narozdíl od standardních katalyzátorů ji snižují v obrovském množství
- reakce s nimi jsou tedy mnohem rychlejší
- katalyzované reakce probíhají přibližně při 100 °C, beze změny objemu či tlaku a v neutárlním prostředí
- výjimky samozřejmě
- při reakci vzniká komplex enzym-substrát
- jeho vznik je reversibilní
- může se rozpadnout na substrát (původní látku) a enzym
- substrát se váže prostřednictvím nevazebných interakcí
- rychle se rozpadá na produkt a enzym
- jeho vznik je reversibilní
Složení a struktura enzymů
Jednosložkové enzymy
- je složen jen z bílkoviny
- jsou to obvykle obrovské globulární proteiny
Dvousložkové enzymy (holoenzymy)
- skládají se z bílkovinné a nebílkovinné složky
Apoenzym
- je to bílkovinná část
- má specifickou strukturu
Aktivní centrum
- místo, na které se váže substrát
Hypotéza zámku a klíče
- enzym tvarem přesně odpovídá tvaru substrátu
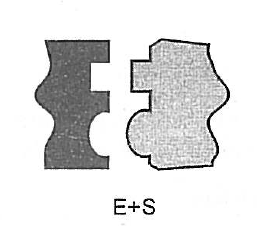
Hypotéza indukovaného přizpůsobení_
-
funkční skupiny substrátu se přizpůsobí tvaru enzymu, aby do sebe přesně zapadli
-
určuje specifitu enzymu
- umožňuje vazbu pouze jednoho typu molekuly
- může se jen omezeně přizpůsobit strukturní variabilitě substrátu
- některé enzymy jsou dokonce stereospecifické
- váží pouze konkrétní stereoizomery
-
pro průběh reakce je velice důležité prostorové uspořádání obou molekul
Kofaktor
- je to nebílkovinná část
- určuje reakční specifitu
- určuje typ reakce
- může se kombinovat s různými apoenzymy a katalyzovat stejný typ reakce u různých substrátů
- může se jednat o:
Vliv na enzymovou reakci
Aktivita enzymu
- je to rychlost katalyzované reakce
- její jednotkou je katal (kat)
- udává množství enzymu, které způsobí přeměnu jednoho molu substrátu za sekundu
- tato jednotka je příliš velká a proto se používají její zlomky ($\mu$kat, nkat)
Teplota
- aktivit enzymu obecně roste s rostoucí teplotou
- teplotní optimum
- bod, ve kterém se růst rychlosti reakce zastaví
- při dalším zahřívaní může efektivita enzymu klesat
- dochází k denaturaci enzymu
- při teplotě 0°C se atkivita enzymu zastavuje
- kozervace mražením
pH
- enzymy jsou na pH extrémně citlivé
- pH optimum
- hodnota pH, při které je enzym nejefektivnější
Koncentrace substrátu
- rychlost enzymové reakce roste s rostoucí koncentrací substrátu
- roste do chvíle, než se obsadí všechna aktivní centra
- potom už zvyšování koncentrace substrátu nemá na rychlost reakce vliv
Koncenetrace enzymu
- je-li dostatek substrátu, roste rychlost reakce s rostoucí koncentrací enzymu
Inhibice enzymu
- projevuje se snižováním aktivity enzymu
Ireverzibilní inhibice
- inhibitor se pevně váže v aktivním centru i mimo něj
- nejčastěji se váže na hydroxyskupiny a thiolové skupiny
- patří sem enzymové jedy
- nejčastějí jsou to ionty těžkých kovů, nervové jedy a některá léčiva
Kompetetivní inhibice
- kompetetivní inhibitor má podobnou strukturu jako substrát
- váže se na aktivní centrum enzymu
- blokuje tvorbu komplexu enzym-substrát
- jeho účinek se snižuje zvýšením koncentrace substrátu
- je reverzibilní
- komplex enzym-inhibitor se snadno disociuje
- např. chemoterapeutika, antibiotiky
Nekompetetivní inhibice
- inhibitor se váže mimo aktivní centrum
- změní se konformace aktivního centra a nemůže vzniknou komplex enzym-substrát
- zvýšení koncentrace substrátu nemá na rychlost reakce vliv
- může být reverzibilní
- záleží na síle vazby komplexu enzym-inhibitor
Inhibice substrátem nebo produktem
- pokud je substrát ve velkém nadytku, může se stát že se na jednu molekilu enzymu naváží dvě molekuly substrátu
- reakce se zpomalí nebo zastaví
- pokud se v reakčním prostoru nahromadí příliš mnoho produktu, dojde k uvedení do rovnovážného stavu
- reakce se zastaví
- neobnoví se, dokud nebude snížena koncentrace produktů
Aktivace enzymu
- v buňce jsou syntetizovány proenzymy (zymogeny)
- nekazalyzují žádnou reakci
- jsou připravené na budoucí katalýzu a jako prekurzory
- jsou aktivovány v bodě potřeby a místě, kde plní svou funkci
- enzymy se mohou aktivovat změnou terciární struktury nebo odštěpením části peptidového řetězce
- bránily přístupnosti aktivního centra
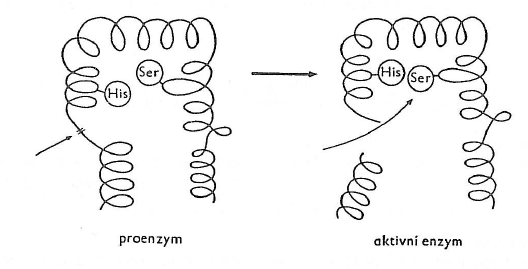
- aktivátorem jsou buď ionty kovů nebo protony
Allosterické enzymy
- skládají se z několika podjednotek
- mohou měnit svoji konformaci a zůstat v aktivní nebo inaktivní formě
- každá podjednotka má své aktivní centrum a allosterické centrum
- slouží pro vazbo efektoru
- inhibitor nebo aktivátor
- slouží pro vazbo efektoru
- allosterické aktivátory se vážou na aktivní formu
- enzym se stabilizuje
- allosterické inhibitory se vážou na inaktivní formu
- enzym se znefunkční
- allosterické efektory si vyrábí buňka sama
- obvyle jsou to produkty nebo meziprodukty metabolismu
- buňka prostřednictvím nich reguluje aktivaci enzymů a vlastní metabolismus
- jsou důležitým článkem multienzymových systémů
- speciálním typem je allosterické regulace je zpětná vazba (feedback loop)
- posleodním produktem metabolické dráhy je inhibitor této metabolické dráhy
Nomenklatura enzymů
Triviální názvy
- můžou se tvořit bez vztahu k substrátu
- většinou končí na suffix -in
- pepsin, trypsin, ptyalin
- můžou se tvořit ve vztahu k substrátu nebo typu reakce
- většinou končí na suffix -asa
- amylasa, laktasa, ureasa, hydrolasa, dehydratasa
Systematické názvy
- tvoří se pomocí názvu substrátu, názvu reakce a suffixu -asa
- cyklochromoxidasa, alkoholdehydrogenasa, acetyltransferasa
Klasifikace enzymů
- jsou rozděleny do šesti tříd podle typu reakce
| Třída | Enzymy | Katalyzovaná reakce | Příklad |
|---|---|---|---|
| 1 | Oxidoreduktasy | oxidace a redukce (přenos elektronů, vodíku nebo reakce s kyslíkem) | dehydrogenasy, oxidasy |
| 2 | Transferasy | přenos skupin atomů mezi dvěma substráty (z donoru na akceptor) | aminotransferasy, fosforylasy |
| 3 | Hydrolasy | hydrolytické štěpení kovalentních vazeb | lipasy, amylasy, peptidasy |
| 4 | Lyasy | nehydrolytické štěpení vazeb $C-C$, vznik dvojné vazby, případně adice na dvojnou vazbu | dekarboxylasy |
| 5 | Izomerasy | intramolekulární strukturní přeměny substrátu | triosafosfátizomerasa |
| 6 | Ligasy (synthetasy) | spojení dvou molekul za účasti makroergické vazby | DNA-polymerasa |
- enzymy získávají unikátní kódy
- jsou čtyřmístné ve formátu: $EC\ w.x.y.z.$
- $EC$ - enzyme comission
- $w$ - označuje třídu enzymu
- $x$ - charakterizuje skupinu chemické vazby, na kterou působí
- $y$ - značí podskupinu třídy
- $z$ - značí pořadí v podskupině
- dají se z nich vyčíst základní vlastnosti enzymů
- jsou čtyřmístné ve formátu: $EC\ w.x.y.z.$