- žívá příroda je složena primárně z organických látek
Biogenní prvky
- jsou to prvky nezbytné pro život
- podle procentuálního zastoupení je dělíme na tři skupiny
- Makrobiogenní prvky
- jsou zastoupeny více než 1 hmotnostní procento
- jsou to kyslík, uhlík, vodík, dusík, fosfor a vápník
- Oligobiogenní prvky
- jejich zastoupení se pohybuje v rozmezí 0.05 do 1 hmotnostního procenta
- jsou to síra, draslík, sodík, hořčík a chlor
- Stopové prvky
- jsou zastoupeny v menší míře než 0.05 hmotnostního procenta
- fyziologický význam některých z nich není zcela objasněn
- přítomnost některých je dokonce nežádoucí v jakékoli konentraci
- k nejznámějším patří rtuť](/notes/research/chemistry/inorganic-chemistry/periodic-table/mercury), [olovo a kadmium
- byl u nich prokázán teratogenní, toxický a případně i karcinogenní účinek
- do těl živých organismů se dostávají jako soli rozpuštěné ve vodě nebo potravě
- v těle se kumulují
- k nejznámějším patří rtuť](/notes/research/chemistry/inorganic-chemistry/periodic-table/mercury), [olovo a kadmium
- přítomnost některých je dokonce nežádoucí v jakékoli konentraci
- v lidském těle o hmotnosti 70 kg je přibližně toto zatoupení jednotlivých prvků
- krom toho se v těle nachází mnoho dalších prvků přibližně do 2 mg
- vyšší obsah vápníku a fosforu je způsoben jejich přítomností v kostech
- zastoupení přechodných kovů je velmi malé, ale jsou velmi důležité
- asi 30% objevených enzymů obsahuje ve své struktuře kov (metaloenzymy)
- jsou důležité při oxidačně-redukčních procesech, hydrolytických štěpeních a při syntetických a izomerických reakcích
- asi 30% objevených enzymů obsahuje ve své struktuře kov (metaloenzymy)
| Obsah hlavních prvků | Obsah stopových prvků | ||
|---|---|---|---|
| Prvek | Obsah | Prvek | Obsah |
| kyslík | 44 kg | železo | 5 g |
| uhlík | 12.6 kg | křemík | 3 g |
| vodík | 6.6 kg | zinek | 1.75 g |
| dusík | 1.8 kg | rubidium | 360 mg |
| vápník | 1.7 kg | měď | 280 mg |
| fosfor | 680 g | stroncium | 280 g |
| draslík | 250 g | brom | 140 mg |
| chlor | 115 g | cín | 140 mg |
| síra | 100 g | mangan | 70 mg |
| sodík | 70 g | jod | 70 mg |
| hořčík | 42 g | hliník | 35 mg |
Metabolismus železa
- železo v organismu existuje primárně ve formě $Fe^{3+}$
- váže se ve formě komplexů
- metabolismus probíhá ve třech pochodech
- zachycení a transport do krve
- transport v organismu
- ochování zásobního železa v organismu
- do organismu se železo dostává primánrě v potravě a ve vodě
- po oddělení se okamžitě váže do polydentátních, často cyklických komplexů s kyslíkovými donory
- těmto látkám se siderofory
- příklad sideforu je třeba ferrichrom
- ferrichrom je velmi pevný a je obalen velkou organickou látkou
- náboj je rozmístěn do velké molekuly
- hydrofilní charakter je tím snížen a umožňuje to prostup přes lipofilní buněčné membrány
- hydrofobní charakter je dále zvýšen přítomností vazeb $C-H$ a alkylů
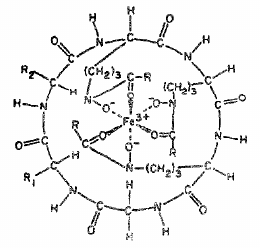
- po zachycení přechází siderofory přes střevní membrány do krve
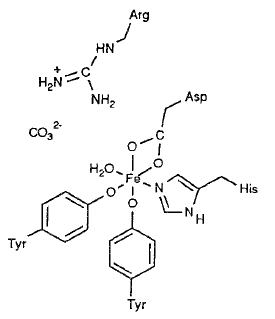
- v krvy jsou ionty železité zachyceny transferrinem
- je to středně velký glykoprotein
- obdobami jsou lactoferrin v mléce, ovotransferrin ve vejcích nebo serotransferrin v tělech králíků
- donory jsou primárně kyslíkové atomy, pouze histidin se váže přes dusík
- uhličitanový anion není přímo vázán, ani arginin
- jejich příomnost zvyšuje pevnost komplexu
- zajišťuje přenos železa do míst kde je potřeba nebo na uskladnění
- je to středně velký glykoprotein
- v krvy jsou ionty železité zachyceny transferrinem
- na biochemických procesech se podílí jen velmi málá část přijatého železa
- většina se ukládá v bílkovině ferritinu
- nachází se v játrech, slezině a kostním morku
- je složen z několika bílkovinových jednotek, které vytváří dutinu, kde se ukládá železo
- součástí struktury jsou některá biologická redukční činidla, která redukují železo na $Fe^{2+}$
- nachází se zde také NADH
- redukcí se sníží pevnost vazeb
- železo samotné je ukládáno v krystalcích látky o přibližném složení $[(Fe(O)OH)_8(FeOPO_3H_2)\cdot{n\ H_2PO_4}]$
- většina se ukládá v bílkovině ferritinu
Přenos kyslíku
- je zprostředkován metaloproteiny
- u vyšších živočíchů jsou to hemoglobin a myoglobin
- hemoglobin se nachází v červených krvinkách
- myoglobin je imobilní v buňkách
- oxidační číslo železa je $II$
Struktura koordinačního okolí železa
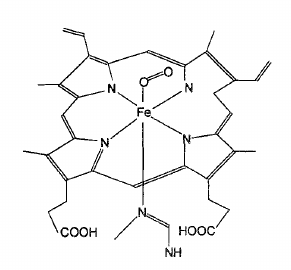
- ve čtyřech polohách okolo železa v jedné rovině jsou vázány dusíkové atomy profinu
- kolem železa tvoří tetragonální pyramidu
- profin se čtyřmi methylovými, dvěma propionátovými a dvěma vinylovými substituenty je označován jako protoporfyrin IX (PIX)
- protoporfyrin IX s navázaným železem se nazývá ferroprotoporfyrin
- v další axiální poloze je vázán atom dusíku imidazolového kruhu histidinu
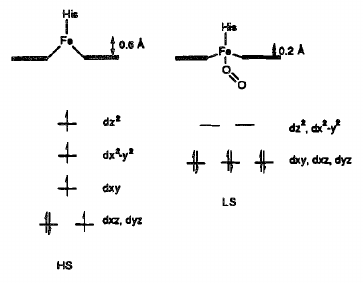
- v případě oxygenovaného stavu (oxyhemoglobin) je v horní axiální poloze vázána kyslíková molekula
- při navázázání se kyslíku se mění koordinace komplexu, ale nemění se oxidační číslo železa
- mění se totiž uspořádání elektronů v orbitalech $d$
- pokud k oxidaci dojde, vznikne tak nový protein methemoglobin
- v případě myoglobinu vzniká metmyoglobin
- není schopen vázat kyslík, ale může vázat molekulu vody
- má hnědou barvu a vytváří se ve starém mase a zaschlé krvy
- červené krvinky obsahují enzym methemoglobinreduktasu, který redukuje malá množství spontánně vznikajícícho methemoglobinu
- pokud k oxidaci dojde, vznikne tak nový protein methemoglobin
- mění se totiž uspořádání elektronů v orbitalech $d$
- změna konfigurace elektronů a tvaru molekuly je navíc doprovázena změnou barvy z velmi tmavě červené na jasně červenou barvu krve
- na šestou axiální polohu se mohou návázat i molekuly $CO, NO$ a $H_2S$
- to je příčinou jejich vysoké toxicity
- při navázázání se kyslíku se mění koordinace komplexu, ale nemění se oxidační číslo železa
Struktura metaloproteinu
- komplex s navázaným kyslíkem je mimořádně stálý a tudíž by nebyl schopen předávat kyslík
Hemoglobin
- koordinační okolí železa je zabudováno ve velké bílkovině
- u sebe ji drží elektrostatické působení skupin $-COO^-$ a $-^+NH_3$
- bílkovina má celkem čtyři segmenty $\alpha_2\beta_2$
- aminokysliny jsou koordinovány do helixu
- komplex je umístěn v hydrofobních dutinách tak, aby nemohlo dojít ke spojení více skupin dikyslíkovým můstkem
- bílkovina zvyšuje afinitu hemu ke kyslíku
- samotný hemoglobin má sám o sobě vysokou afinitu ke kyslíku, která je v tělech živých organismů snižována dalšími látkami
- u člověka je to bisfosfoglycerát (BPG) a u ostatnách živočichů třeba inositolhexafosfát (IHP) nebo adenosintrifosfát (ATP)
- samotný hemoglobin má sám o sobě vysokou afinitu ke kyslíku, která je v tělech živých organismů snižována dalšími látkami
- některé hemoglobiny mají různou strukturu
- změny v aminokyselinových zbytcích na povrchu bílkoviny není málo běžná a zároveň je relativně neškodná
- změny aminokyselinových zbytků vně molekuly způsobuje destabilizaci celé bílkoviny
- při degradaci se tvoří produkty známé jako Heinzova tělíska
- degradační produkty hemu se potom adsorbují na membránu erythrocytů a způsobují jejich předčasnou destrukci
- nositelé těchto nestabilních hemoglobinů trpí chorobou hemolytickou anemií
- změny v oblasti vazebného místa kyslíku mohou stabilizovat formu hemu obsahují trojmocné železo
- tím se zamezí vázání kyslíku
- nositelé těchto hemoglobinů trpí chorobou methemoglobinemií
- mají obvykle namodralou pleť
Myoglobin
- obsahuje jednu molekulu profinu
- v buňkách udržuje kyslík před samotným použitím
- snadno z hemoglobinu přebírá kyslík, protože kyslík je v myoglobinu stabilnější
Přenos oxidu uhličitého
- krom přenosu kyslíku usnadňuje hemoglobin také přenos oxidu uhličitého v krvy
- navázáním kyslíku na hem se uvolní s proteinu protony
- tomuto jevu se říká Bohrův efekt
- při depozici kyslíku se tedy protony zachycují zpátky
- protony vznikají hydratací plynného oxidu uhličitého, který je poté snadnejší ve formě hydrogenuhličitanu
- hydratace je velmi pomalá a je asi 100x katalizovaná enzymem karbonátdehydratasou
- pokud enzym chybí, tovří se v krvy a tkáních bublinky špatně rozpustného oxidu uhličitého
- hydratace je velmi pomalá a je asi 100x katalizovaná enzymem karbonátdehydratasou
- protony vznikají hydratací plynného oxidu uhličitého, který je poté snadnejší ve formě hydrogenuhličitanu
Přenos elektronů
- koordinace železa je zcela analogická sloučeninám přenášejících kyslík
- jedná se o menší bílkoviny
- charakteristická je vazba $Fe-S$
- pochází z cysteinových zbytků
- železo přechází mezi oxidačními stavy $II$ a $III$
Rubredoxin
- obsahuje jeden atom železa
- atom železa je koordinován čtyřmi atomy síry
- přenášejí jeden elektron
Ferredoxiny
- jsou to větší látky
- obsahují několik železných atomů v klasrech $Fe_2S_2$ nebo $Fe_4S_4$
- umožňují přenos více elektronů najednou
Chlorofyly
- jsou to zelená barviva
- účástní se fotosyntézy
- je to proces, při kterém se světelná energie přeměňuje na chemickou energii
- centrálním atomem je hořčík
- koordinační okolí hořčíku je příbuzné hemu
- chlorin
- liší se pouze v uhlovodíkových zbytcích okolo profinového cyklu
- koordinační číslo hořčíku je 5 a někdy 6
- barevnost zpsůobují konjugované dvojné vazby chlorinu
- struktura molekuly se také liší podle typu
- na hydrofilní chlorin je vázán hydrofobní řetězec
- jedná se tedy o membránový lipid zabudovaný do membrán tylakoidů
- voda vystupuje jako další významný ligand, který shlukuje molekuly do větších klastrů
- doposud není známo proč je hořčík jediným vhodným kovem
- je nutný i k aktivaci enzymů přenášejících fosforečnany
- ovlivňuje hydrolytické procesy, při nichž se z ATP tvoří ADP a následně AMP
- existují v několika formách
- na hydrofilní chlorin je vázán hydrofobní řetězec
Formy chlorofylu
Chlorofyl A
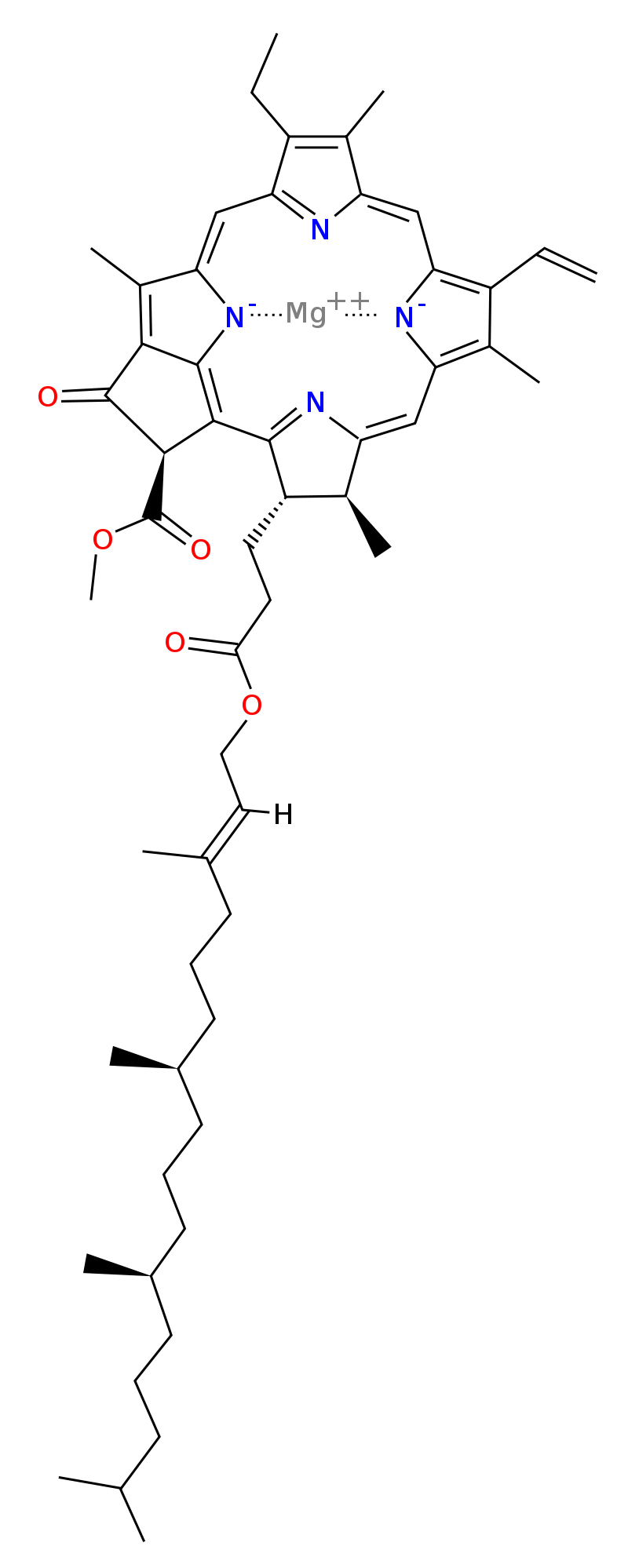
- je nejběžnější a nachází se ve všech organismech schopných fotosyntézy
Chlorofyl B
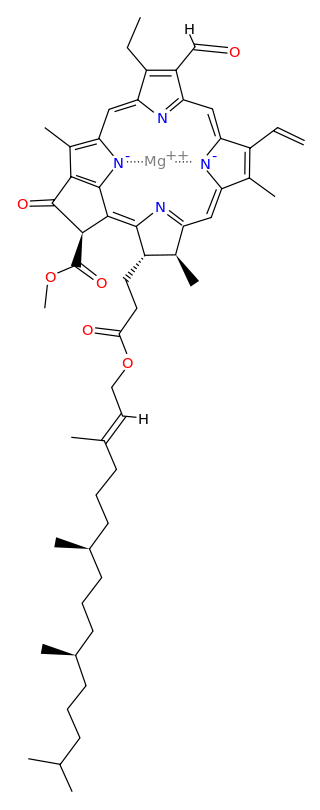
- nachází se vy vyšších rostlinách a řasách
Chlorofyl C
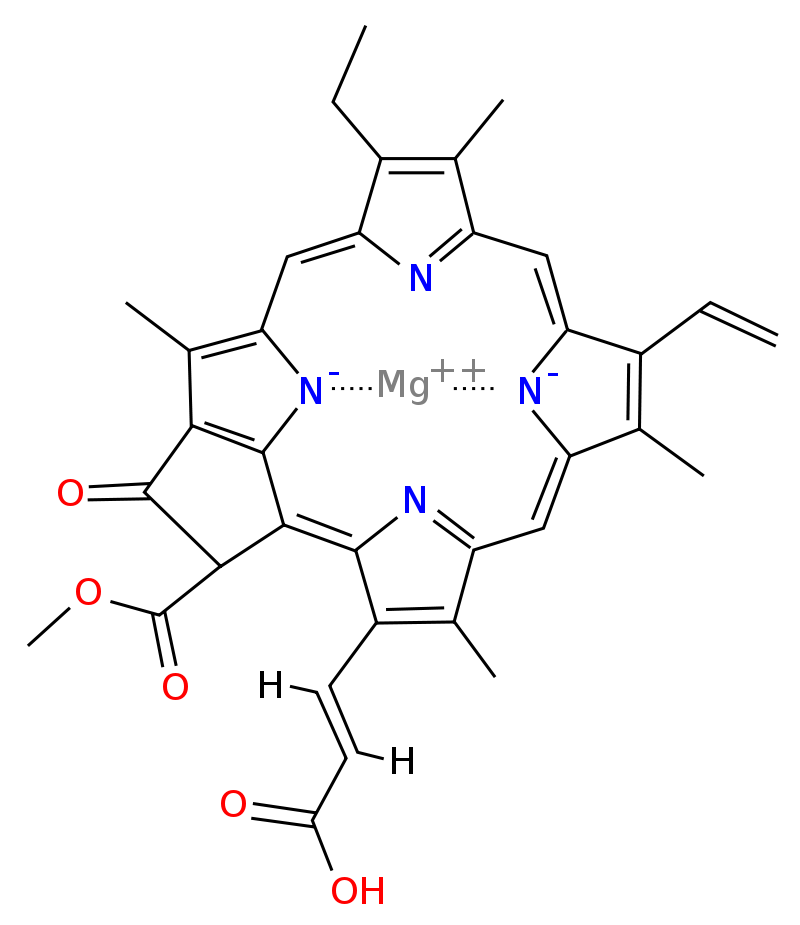
- je obsažen v hnědých řasách a rozsivkách
Chlorofyl D
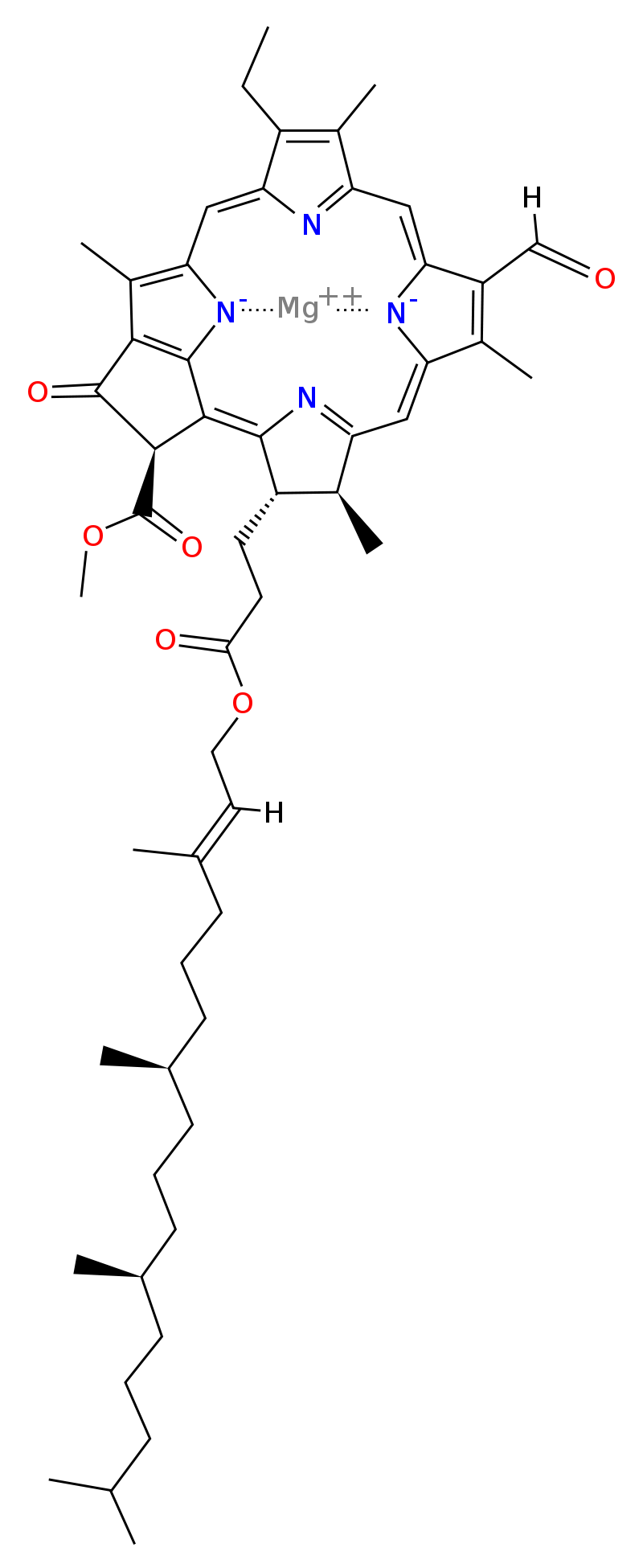
- je obsažen v některých bakteriích schopných fotosyntézy
Chlorofyl F
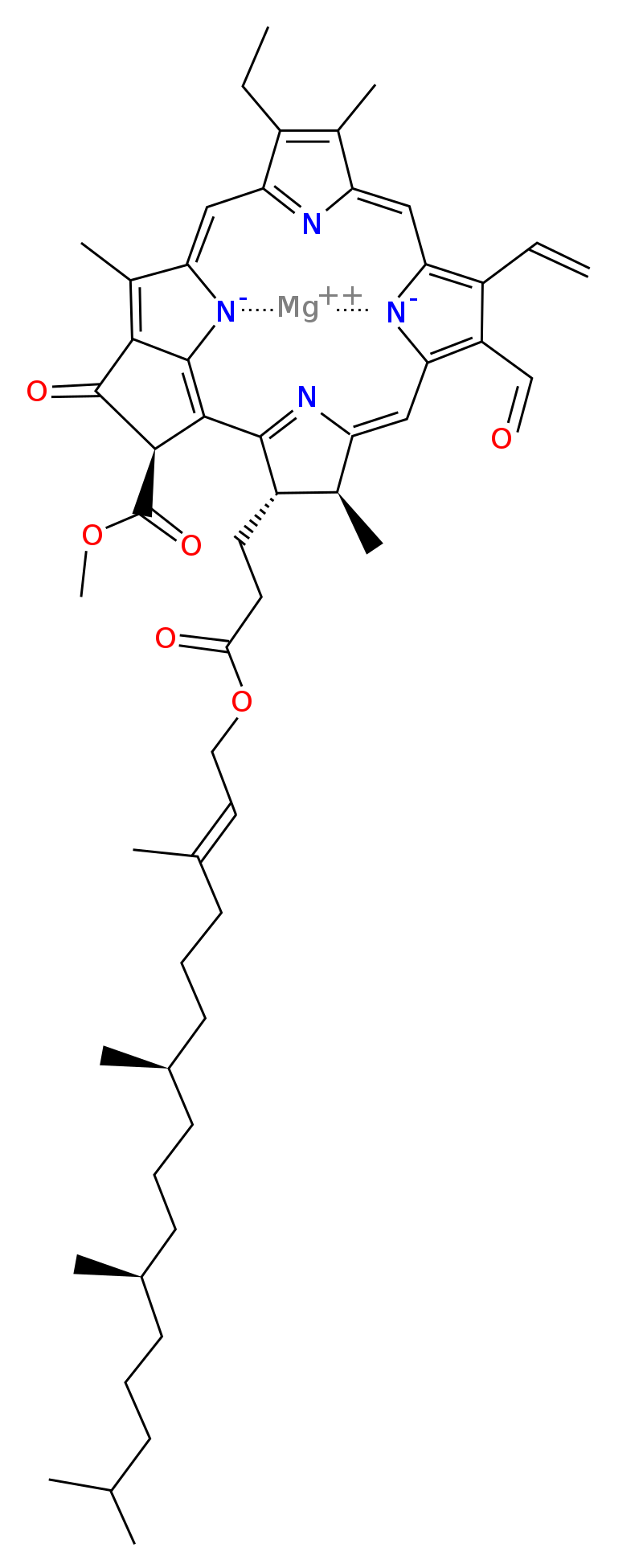
- byl identifikován teprve nedávno
- nachází se v konkrétních rostlinách