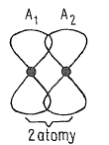
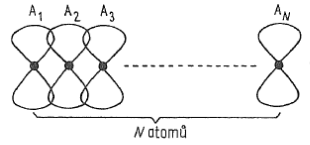
- modely klasických chemických vazeb neodopovídají přesně skutečnosti v pevných látkách
Pásový model elektronové struktury
- mezi dvěma atomy s elektrony v orbitalech $p$ vzniká vazba $\pi$
- mezi čtyřmi atomy s elektrony v orbitalech $p$ vzniká speciální typ vazby
- vznikají čtyři nové molekulové orbitaly
- $\psi_1^b$ - pod spojnicí jader
- $\psi_2^b$ - pod spojnicí jader
- $\psi_3^*$ - nad spojnicí jader
- $\psi_4^*$ - nad spojnicí jader
- dochází ke vzniku delokalizovaného systému
- vzniká třeba v molekule butadienu
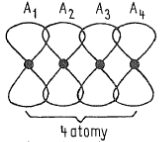
Schéma prolnutí atomových orbitalů p více atomů - mezi dvanácti atomy bude sitace podobná
- energetický rozdíl krajních orbitalů není velký
- vznikají čtyři nové molekulové orbitaly
- podobná situace nastává ve vazbě mezi $n$ atomy
- vzniká $n$ nových molekulových orbitalů
- $\psi_1^b$ - pod spojnicí jader
- …
- $\psi_n^*$ - nad spojnicí jader
- vytvoří se souvislí energetický pás (kvazikontinuální pás)
- vzniká $n$ nových molekulových orbitalů
- k překryvu dochází i mezi orbitaly $s$
- krystalové struktury pevných látek jsou navíc trojrozměrné, tudíž překryvy orbitalů mohou být ještě složitější
- mřížka je tedy složena z překrývajících se pásů
- jejich energie určuje maximální a minimální energii elektronu
- tyto pásy energie se nazývají dovolené
- pásy energie nad a pod tímto vymezením se nazývají zakázané
- jejich energie určuje maximální a minimální energii elektronu
- elektrony ležící ve vnitřních atomových orbitalech atomu jsou minimálně ovlivněny nelokalizací vyšších orbitalů
- orbitaly valenční sféry do sebe hluboko pronikají a mění se na soubory výrazně delokalizovaných orbitalů
- jejich obsazení elektrony určuje fyzikální vlastnosti látek
- vyšší nezaplněné orbitaly spolu interagují jen formálně
- na vlastnosti nemají vliv
Uspořádání elektronů v elektronových pásech
- zaplňují se podle stejných pravidel jako atomové orbitaly
- elektrony je zaplňují tak, aby měli ve výsledku co nejmenší energii
- do dovoleného pásu o $n$ hladinách může být umístěno maximálně $2n$ elektronů
- teprve po zaplnění pásu energeticky nižšího se zaplňuje pás energeticky vyšší
Fermiho hladina
- nejvyšší energetická hladina, které je možné za ideálních podmínek ($0\ K$, žádné elektromagnetické záření,…) dosáhnout
- její hodnota se nazývá Fermiho energie $F$
- její poloha určuje klíčové vlastnosti pevné látky
Vodivostně valenční pás
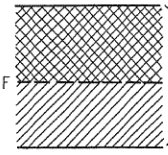
- leží uvnitř dovoleného pásu
- počet elektronů postačuje jen k částečnému zaplnění dovoleného pásu
- vzniká v krystalech kovů, slitin a intermetalických sloučenin
- dochází ke vzniku velmi pevné kovové vazby
- takový systém je vodivý a obsahují ho vodiče
Valenční pás ($\Delta{E}>5\ eV$)
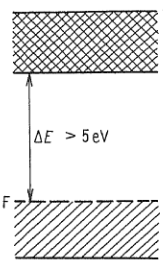
- leží na horním okraji dovoleného pásu
- dovolený pás je plně obsazen
- elektrony nejsou volně pohyblivé
- takový systém je nevodivý a obsahují ho izolanty
- rozdíl energií zaplněného dovoleného pásu a dalšího dovoleného pásu s nejmenší energií je alespoň $5\ eV$
- ani značný tepelný pohyb neumožní excitaci ze zaplněného dovoleného pásu
- rozdíl mezi energiemi dovolených pásu se nazývá šířka zakázaného pásu
Valenční pás ($\Delta{E}<3\ eV$)
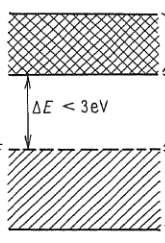
- za ideálních podmínek je situace podobná situaci v předchozím případě
- při dostatečné tepelném pohybu nebo jiném způsobu excitace mohou elektrony přeskočit do vyššícho dovoleného pásu
- takový systém je vodivý a obsahují ho polovodiče
Elektricky vodivé látky
- vodiče
- jsou to látky, jejichž měrná elektrická vodivost (konduktivita) se pohybuje v rozmezí $1$ až $10^6\ \Omega^{-1}cm^{-1}$
- vyskytuje se hlavně v kovech, slitinách a intemetalických sloučeninách
Kovová vazba (plynový model elektronové struktury)
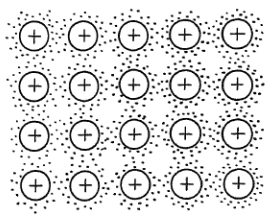
- systém delokalizovaných elektornů se rozprostírá po celé mřížce
- vzniká elektronový plyn
- rozdílné naboje plynu a kationtů udržují mřížku pohromadě
- elektronová hustota není ve všech dovolených pásech konstantní
- směrem do středu pásů stoupá
- směrem ke kraji klesá
- systém má tolik maxim hustoty, z kolika dovolených pásu se skládá
- při zahřívání se pohyb elektronů znesnadňuje
- vzrůstá průměrná výška vodivostního dovoleného pásu (je umístěn nad valenčním)
- elektrony do něj nemohou snadno přeskočit
- to vysvětluje, že vodivost s rostoucí teplotou klesá
- při snižování teploty naopak dochází k supravodivosti
- pro elektrony je mnohem snadnější přecházet mezi valenčním a vodivostním pásem
- supravodiče
- jsou to materiály, které dokáží dosáhnout supervodivosti už při teplotě $10\ K$
- snahou je najít takové materiály, které by toho byly schopny za vyšších teplot nebo dokonce za normální teploty ($25°C$)
- to se zatím nepodařilo
Poruchy výstavby kovové mřížky
- experimentálně zjištěná pevnost kovů je o řády nižší než jejich teoretická pevnost
- je to způsobeno poruchami v krystalické mřízce
- skutečná mřížka obsahuje mnoho nepravidelností
Dislokace
- poruchy lineárního typu
Dislokace hranová
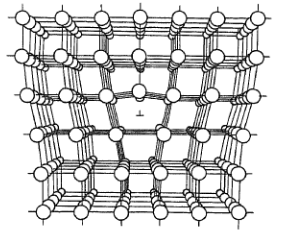
- jedna ze svislých vrstev mřížky končí na pomyslné přímce porcházející krystalem
- ostatní vrstvy se pak této anomálii přizpůsobují
- může dojít k jejímu vyplutí na povrch krystalu
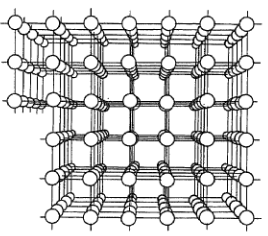
Vyplutí hranové dislokace
Dislokace šroubová
- sled rovnoběžných vrstev atomů je nastřižen
- atomy, které leží v rovině střihu se potom mění na šroubové plochy dařilo se vypěstovat jehlice kovů, které dosahují téměř teoretické pevnosti
Elektricky nevodivé látky
- izolanty
- jsou to látky jejichž měrná elektrická vodivost se pohybuje v rozmezí $10^{-10}$ až $10^{-20}\ \Omega^{-1}cm^{-1}$
- vyskytuje se většinou u látek s iontovou vazbou nebo kovalentní
Iontové izolanty
- jednotlivý účastníci vazeb vkládají do dovoleného pásu přesně tolik elektronů, kolik je potřeba na jeho zaplnění
- elektrony se nemohou volně pohybovat a systém je nevodivý
- jsou špatnými vodiči tepla a propouštějí elektromagnetické zářnení
- delokalizace orbitalů je mnohonásobně menší než v kovové vazbě
Poruchy výstavby iontové mřížky
Dislokace
- podobná jako u kovové vazby
Bodové poruchy
- v mřízce chybí atom na místě, kde by měl ideálně být
Shottkyho poruchy
- vakance vzniklá zahřátím krystalu

Schéma vakance zahřátím - atom se vlivem tepla oddělí a přesune na povrch krystalu
- vakance vzniklá působením kovových par

Schéma vakance působením kovových par - páry kovu jsou plyné kationty kovu
- kation se přidá do mřížky
- uvolní elektrony, které zaplní aniontové vakance
- přidání aniontu do ideální mřížky

Schéma poruchy přidáním aniontu - vznikají kationtové vakance
- kationty se pokouší o vyrovnávání zvýšením svého oxidačního stavu
Frenkelovy poruchy
- jsou způsobeny vmezeřením atomů do mřížky
- jejich následkem je migrace atomů v mřížce
Kovalentní izolanty
- jsou to homogenní mřížky, jejichž účastnící jsou svázány vazbami $\sigma$
- do delokalizovaného systému dávají přesně tolik elektronů, kolik je potřeba k zaplnění valenčního pásu
Elektricky polovodivé látky
- polovodiče
- jsou to látky, jejichž měrná elektrická vodivost se pohybuje v rozmezí $10^{-10}$ až $10^{4}\ \Omega^{-1}cm^{-1}$
- v mřížce jsou atomy vázány spíše kovalentními vazbami s menšími přesahy do vazby kovové
- tyto vlastnosti mají nejčastěji prvky blízko rozhraní kovů a nekovů a jejich sloučenin
- šířka zakázaného pásu je relativně malá
Vlastní polovodiče
- jsou to látky, které mají polovodivé vlastnosti
- kompozice valenčního a vodivostního pásu je při teplotě $0\ K$ je podobná izolantům
- za zvýšení teploty mohou tepelně excitované elektrony přeskočit do vodivostního pásu
- po excitovaných elektronech zbydou ve valenčním pásu díry
- ty umožňují pohyb elektronů
- proud je veden jak ve valenčním pásu, tak ve vodivostním pásu
- ve valenčním pásu se elektrony pohybují nesnadno
- nositeli elektrického proudu jsou díry
- ve vodivostním pásu je mnohem více prostoru pro elektrony
- většina proudu prochází tudy
- ve valenčním pásu se elektrony pohybují nesnadno
Nevlastní polovodiče
- příměsové polovodiče
- jsou to látky, do kterých jsou vneseny atomy, které podstatně mění jejich fyzikální vlastnosti
- nastává to standartně v přírodě
- při růstu krystalu dochází k substitučním poruchám
- např. krystal křemíku
- nastává to standartně v přírodě
Polovodiče typu $n$
- heteroatomy mají o jeden elektron navíc než zbytek mřížky
- v zakázaném pásu se vytvoří několik energeických hladin pro jednotlivé přebývající elektrony
- donorové hladiny
- jejich přechod do vodivostního pásu je tak snadnější a nastane tak už při malém zvýšení teploty
Polovodič typu $p$
- heteroatomy mají o jeden elektron míň
- nastává obdobná situace
- elektrony nezapojené do mřížky mají vyšší energii než elektrony do ní zapojené
- jejich energetická hladina je nad valenčním pásem
- akceptorové hladiny
- snadno přijme další elektrony z valenčního pásu
- jejich energetická hladina je nad valenčním pásem
Vlastnosti polovodičů
- vodivost je velmi závislá na teplotě
- čím vyšší teplota, tím vyšší vodivost
- tím se polovodiče liší od kovů
- fotoelektrická vodivost a vnitřní fotoelektrický jev
- polovodiče pohlcují záření zvenčí
- fotony mají nižší energii než by byla potřeba k vyražení elektrony z valenčního pásu mimo krystal
- v takovém případě dojde k excitaci elketronu do vodivostního pásu
- vodivost při osvětlení vzrůstá
- složitější mechanismus polovodiče může vyvolat anomálii a efekt obrátit
- Hallův jev
Polovodič, kterým protéká proud účinkem stejnosměrného elektrického pole a kterým je přitom umístěn do homogenního magnetického pole, jehož siločáry jsou kolmé k siločarám pole elektrického, se na protilehlých plochách objevují elektrické náboje, a tím i nové elektrické pole.