- narozdíl od amorfních látek mají určité vlastnosti
- jsou to látky, které mají velmi pravidelný tvar
- na povrchu se projevuje pravidelným geometrickým útvarem
- je dána mnohonásobným opakováním základních jednotek v krystalické mřížce
Krystalová mřížka
- určuje tvar celého krystalu
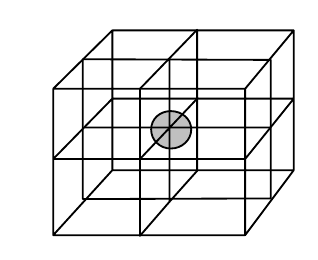
- nejmenší částí je elementární buňka
- slouží k popisu tvaru krystalu
- obsahuje všechno, co se ve zbytku mřížky opakuje
- mřížkové body
- středy atomů
- vyznačují se tečkami
Příslušnost atomů
- vzorcová jednotka
- počet atomů v jedné elementární buňce
- jednotlivé atomy mohou příslušet více buňkám najednou
- pokud se atom nachází na vrcholu, náleží každé buňce, které je součástí, z 1/8
- pokud se atom nachází na hraně, náleží každé buňce, které je součástí, z 1/4

- pokud se atom nachází ve stěně, náleží každé buňce, které je součástí, z 1/2
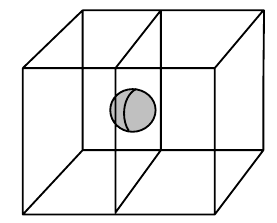
- pokud je atom v těžišti, náleží celý své buňce
- nachází se v tělesně centrovaných mřížkách
Tvary mřížek
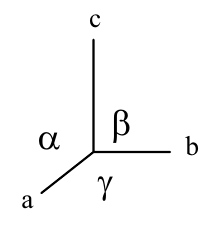
- každá mřížka je charakterizovaná mřížkovými parametry
| Krystalografická soustava | Tvar | Parametr |
|---|---|---|
| krychlová (kubická) | 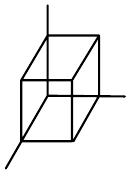 |
$a=b=c$, $\alpha=\beta=\gamma=90°$ |
| čtverečná (tetragonální) | 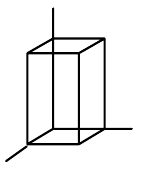 |
$a=b\neq{c}$, $\alpha=\beta=\gamma=90°$ |
| kosočtvrečná (ortorombická) | 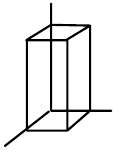 |
$a\neq{b}\neq{c}$, $\alpha=\beta=\gamma=90°$ |
| jednoklonná (monoklinická) | 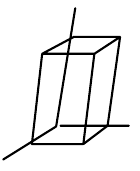 |
$a\neq{b}\neq{c}$, $\alpha=\gamma=90°,\beta\neq{90°}$ |
| trojklonná (triklinická) | 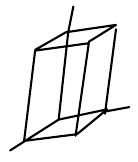 |
$a\neq{b}\neq{c}$, $\alpha\neq\beta\neq\gamma\neq{90°}$ |
| šesterečná (hexagonální) |  |
$a=b\neq{c}$, $\alpha=\beta=90°,\gamma=120°$ |
| klencová (romboedrická) | 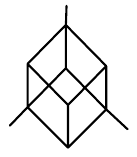 |
$a=b=c$, $\alpha=\beta=\gamma\neq{90°}$ |
Atomové krystaly
- např. diamant nebo karbid křemíku
- jsou velmi pevné a mají vysoké tepltoy tání
- atomy jsou vázány kovalentní vazbou
Iontové krystaly
- např. chlorid sodný
- jsou pevné, ale jsou velmi lehce rozpustné ve vodě
- atomy jsou vázány iontovou vazbou
Molekulové krystaly
- např. molekula síry $S_8$ nebo většina sacharidů
- krystaly nejsou tvořeny přímo atomy, ale mezi celými molekulami
- interakce mezi jednotlivými molekulami jsou velmi slabé, proto je často výdáme ve formě prášku
- jejich vodné roztoky nevedou elektrický proud, protože netvoří elektrický proud
Kovové krystaly
Vrstevnaté krystaly
- např. grafit
- jednotlivé vrstvy jsou velmi pevné ale od sebe se snadno odlamují