Reakční kinetika
- reakční kinetika studuje rychlost a faktory ji ovlivňující reakce a reakční mechanismy
- podmínkám, za kterých reakce probíhá, se říká reakční
- reakční mechanismy jsou pořadí dílčích reakcí
- Izolované reakce
- v soustavě probíhá jedna samostatná reakce
- Simultální reakce
- v soustavě probíhá několik reakcí
- reverzibilní reakce
- z reaktantů vznikají produkty a z produktů zase reaktanty
- obecně: $A+B\rightleftharpoons{C+D}$
- např.: $H_{2}+I_{2}\leftrightharpoons{2\ HI}$
- paralelní reakce
- reaktanty reagují různým způsobem a vznikají různé produkty
- typické pro organické reakce
- obecně: $A+B\longrightarrow{C}\ \lor\ A+B\longrightarrow{C}$
- např.: $CH_{3}CH_{2}OH\longrightarrow{CH_{2}=CH_{2}+H_{2}O}\ \lor\ CH_{3}CH_{2}OH\longrightarrow{CH_{3}CHO+H_{2}}$
- konsekutivní reakce
- produkty jedné reakce jsou výchozí látkou další reakce
- obecně: $A+B\rightarrow{C+D}\rightarrow{E+F}$
Reakční rychlost
- rychlost, kterou se spotřebovávají výchozí látky a tvoří se produkty
- je to změna koncentrace reagujících látek za jednotku času
- $v=\frac{|\Delta{c}|}{\Delta{t}}$
- pro rychlost reakce $xA+yB\rightarrow{C}$ platí kinetická rovnice
- $v=k[A]^{x}[B]^{y}$
- $v$ - reakční rychlost
- $k$ - rychlostní konstanta
- $c(A),c_{A},[A]$ - koncentrace výchozí látky
- $x,y$ - stechimetrické koeficienty reakce
Aktivační energie
- reakce probíhá srážením částic v prostoru
- aby byli srážky efektivní, musí mít částice správnou orientaci v prostoru a dostatečnou kinetickou energii
- minimální energie nutná k průběhu reakce se bazývá aktivační energie ($E_{A}$)
- umožňuje vznik aktivovaného komplexu
- aktivovaný komplex je nestabilní celek jehož rozpadem vznikají prodkty
- zanikají v něm staré vazby a tvoří se vazby nové
- obecně: $A_{2}+B_{2}\leftrightharpoons{[A_{2}B_{2}]}\rightarrow{2\ AB}$
- Graf změn energie částic v průběhu reakce
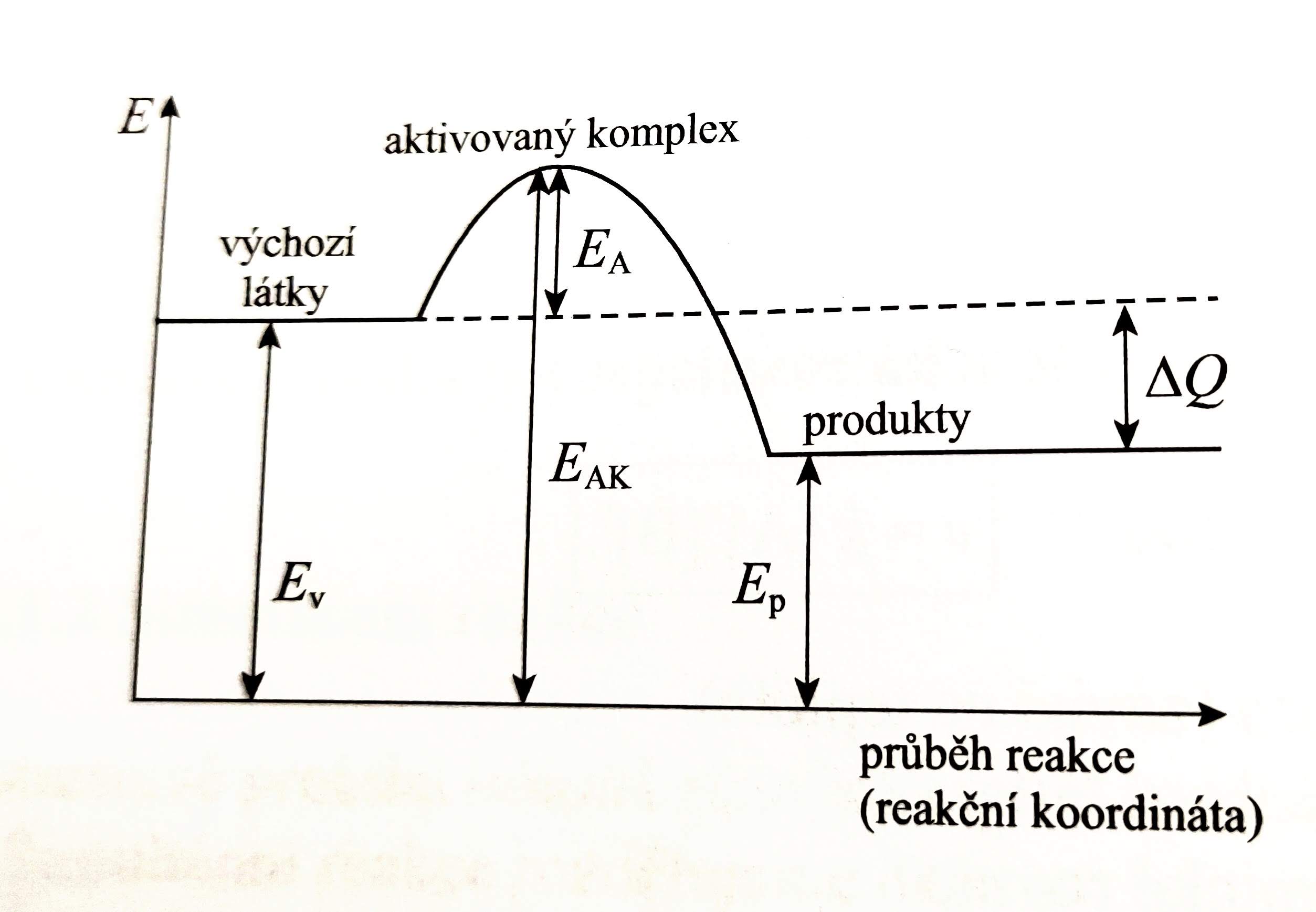
- $E_{v}$ - potenciální energie reaktantů
- $E_{p}$ - potenciální energie produktů
- $E_{A}$ - aktivační energie
- $E_{AK}$ - potenciální energie aktivovaného komplexu
- $\Delta{Q}$ - reakční teplo
- aktivační energie je rovna rozdílu potenciálních energií aktivovaného komplexu a reaktantů: $E_{A}=E_{AK}-E_{v}$
Katalýza
- ovlivňování rychlosti chemické reakce přidáním katalyzátoru
- reakce, které při katalýze probíhají označujeme jako katalytický cyklus
- Homogenní katalýza
- katalyzátor je ve stejné fázi jako ostatný složky
- katalýza probíhá většinou v kapalné fázi
- reakční složky a katalyzátor jsou rozpuštěny v inertním rozpouštědle
- nevýhodou jsou komplikace při oddělování produktů a kytalyzátoru
- výhodou je účinnost a selektivita
- Heterogenní katalýza
- katalyzátor je v jiné fázi než ostatní složky
- katalyzátorem je obvykle pevná látka, na kterou se složky v plynném nebo kapalném skupenství adsorbují a po vzniku produktů se desorbují
- katalyzátor je obvykle navíc rozptýlen na nějakém nosiči pro co největší povrch
- Katalyzátor
- látka, která zvyšuje rychlost chemicé reakce
- enzymy jsou biokatalyzátory s vysokou specificitou
- reagují obvykle jen s jednou látkou
- na konci reakce se katalyzátor regeneruje
- proto se ho přidává jen málo na velké množství reaktantů
- katalyzovaná reakce probíhá ve dvou stupních:
- vzniká nestabilní meziprodukt jedné z výchozích látek a katalyzátoru
- meziprodukt se při reakci s druhou reagující látkou rozkládá na produkt a regenerovaný katalyzátor
- katalyzátor snižuje aktivační energii změnou reakčního mechanismu
- proto reakce probíhá rychleji
- přítomnost katalyzátoru označujeme jeho vzorcem nad nebo pod šipkou
- např.: $N_{2}(g)+3\ H_{2}(g)\stackrel{Fe(s)}{\longrightarrow}2\ NH_{3}(g)$
- Inhibitor
- zpomalují reakce
- stabilizátory
- reagují s meziprodukty řetězových reakcí
- katalytické jedy
