Alkalické kovy
- lithium, sodík, draslík, rubidium, cesium, francium
- tvoří skupinu I.A mimo vodík
- konfigurace valenční sféry je $ns^1$
Zisk a výskyt alkalických kovů
- v příordě se vyskytuje nejvíce sodík a draslík (ca. 2.5%)
- lithium a cesium většinou doprovází hlinitokřemičitanové minerály
- rubidium nemá samostatný minerál a doprovazí většinou cesium
- sodík a cesium jsou monoizotopické
- lithium má dva izotopy $^7Li$ a $^6Li$
- druhý izotop je významný při výrobě tritia
- draslík a rubidium mají každý jeden radioaktivní izotop s dlouhým poločasem rozpadu
- $^{40}K$ ($\tau_{\frac{1}{2}}=1.27\cdot{10^9}$ let) a $^{87}Rb$ ($\tau_{\frac{1}{2}}=5.7\cdot{10^{10}}$ let)
- francium je známé ve 21 izotopech, z nichž všechny jsou radioaktivní
- nejstálejší je $^{223}Fr$ ($\tau_{\frac{1}{2}}=21.8$ min)
Vlastnosti alkalických kovů
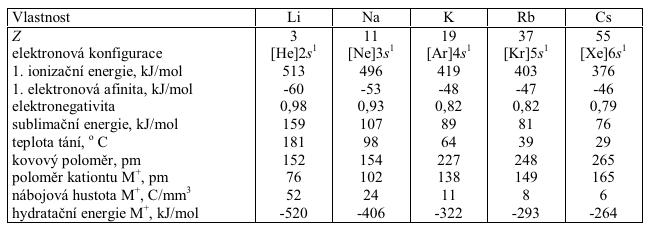
- jsou velmi měkké
- jsou stříbrně lesklé
- mají velmi nízkou hustotu
- lithium ma nejnižší hustotu ze všech pevných látek
- dobře vedou elektrický proud a teplo
- charakteristicky barví plamen
- mají nízké body tání a varu
- slitina 12% $Na$, 47% $K$ a 41% $Cs$ má nejnižší bod tání ze všech kovových slitin (-78°C)
Vazebné možnosti
- ve valenční sféře mají pouze jeden elektron
- snadno jej odštěpují
- mají nízkou hodnotu ionizační energie
- nižší čím vyšší je protonové číslo
- kation alkalického kovu má stejnou elektronovou konfiguraci jako nejbližší vzácný plyn
- mají nejnižší elektronegativitu ze všech prvků
- snadno tvoří iontové vazby
- na vazbě se už další elektrony kovu nepodílejí
- lithium může vytvářet vazby s vyšším podílem kovalentnosti
- projevuje se to rozpustností sloučenin lithia v organických rozpouštědlech
- pokud je vazebným partnerem prvke s nízkou elektronegativitou, podíl kovlantnosti je vyšší
- v elementárních kovech se vyskytuje kovová vazba
- jejich ionty mají velmi malou tendenci být středovými atomy koordinačních sloučenin
ou extrémně reaktivní
- mají silné redukční schopnosti
- zvětšují se s protonovým číslem
- uskladňují se v petroleji
Chemické reakce alkalických kovů
- Oxidace v laboratorních podmínkách
- rychle se pokrývají vrstvičkou směsi jejich oxidů, hydroxidů a uhličitanů
- lithium se pokrývá také vrstvičkou nitridu $Li_3N$
- Spalování na vzduchu
- poskytují oxidy a peroxidy
- lithium - $LiO_2$
- je znečištěný peroxidem a nitridem
- sodík - $Na_2O_2$
- draslík - $K_2O_2$
- rubidium - $Rb_2O_2$
- cesium - $Cs_2O_2$
- Spalování v kyslíku
- posktují oxidy, peroxidy a hyperoxidy
- opatrným rozkladem hyperoxidů byli připraveny seskvioxidy $M_2O_3$
- lithium - $LiO_2$
- sodík - $Na_2O_2$
- draslík - $KO_2$
- rubidium - $RbO_2$
- cesium - $CsO_2$
- Reakce s vodou
- reagují bouřlivě
- poskytují hydroxidy a vodík
- $2\ M+2\ H_2O\longrightarrow{2\ MOH}+H_2$
- kovy se taví a zapalují
- u toho exploduje vznikající vodík
- prudkost reakce se zvyšuje s protonovým číslem
- Reakce s vodíkem
- reakcí s vodíkem vznikají hydridy
- $2\ M+H_2\longrightarrow{2\ MH}$
- jsou to krystalické pevné látky
- jejich termická stabilita roste s protonovým číslem
- prudce reagují s vodou
- obdobně reagují s alkoholy
- Rekace s elementárními nekovy
- přímo se slučují se sírou
- vznikají _sulfidy _$M_2S$
- jsou dobře rozpustné ve vodě
- přímo se slučují s halogeny
- vznikají halogenidy $MX$
- mají bouřlivý průběh
- s uhlíkem a křemíkem reaguje pouze lithium
- vzniká karbid lithný $Li_2C_2$ a disilicid hexalithia $Li_6Si_2$
- Reakce se sloučeninami jiných kovů
- reagují roztavené s oxidy a halogenidy ostatních kovů a redukují je
- využívá se toho v metalurgii
- za vyšších teplot reagují s amoniakem
- produktem jsou amidy $MNH_2$ a vodík
Lithium
- jeho nedostatek v organismu je příčinou některých psychických chorob
- na léčbu některých psychologických chorob, narkomanie a alkholosimu se stále používá
- jeho sloučeniny působí i proti skleróze, vysokému krevnímu tlaku a curkovce
- jeho zdrojem jsou minerální vody a některé rostliny
Sodík
- je to nejdůležitejší extracelulární prvek
- pomáhá udržovat osmotický tlak a pH v tělních tekutinách
- je součástí pufrových systémů v krvi
- spolu s draslíkem tvoří elektrický potenciál na membránách nervových buněk
- pomáhá při transportu některých látek přes membránu
- asi třetina tělních zásob je uložena v kostech
- nadbytek sodíku způsobuje poruchy vodního hospodářství organismu
Draslík
- je to typický intracelulární prvek
- pomáhá udržovat elektrickou a osmotickou rovnováhu na buněčných membránách
- je nezbytný pro syntézu bílkovin
- účastní se fotosyntézy
- většinou je vázán na bílkoviny
- významně se podílí na kotrakci svalů a přenosu nervových vzruchů a metabolismu sacharidů a bílkovin
- poměr draslíku a sodíku je důležitý pro nervosvalovou dráždivost
- nedostatek i nadbytek draslíku způsobuje únavu a poruchy funkcí svalů a centrální nervové soustavy
Sloučeniny alkalických kovů
- ve sloučeninách naprosto ztrácí svou reaktivitu
- je to přechodem do oxidačního stavu $I$
- mají konfiguraci vzácného plynu a malý kladný náboj
- v případě těžších alkalických kovů mají i velký poloměr
- kationty jsou bezbarvé a s vodou nehydrolizují
- většina sloučenin se dobře rozpouští a tvoří silné elektrolyty
- primárně se využívají sloučeniny sodné a draselné
- pro výrobu sodný sloučenin slouží primárně halit $NaCl$ a mořská sůl
- pro výrobu draselných solí se používají minerály
- sylvín $KCl$
- karnalit $KMgCl_3\cdot{6\ H_2O}$
- kainit $KMgSO_4Cl\cdot{3\ H_2O}$
- schönit $K_2Mg(SO_4)_2\cdot{6\ H_2O}$
- nitrokalit $KNO_3$
Sloučeniny s kyslíkem
Oxidy $M_2O$
- lze je připravit reakcí peroxidů nebo hyperoxidů získaných spalováním s příslušnými elementárními kovy
- mají bazický charakter a jsou zásadotvorné
- oxid lithný $Li_2O$
- připravuje se rozkladem uhličitanu lithného
Peroxidy $M_2O_2$
- ve vodě hydrolyzují a poskytují hydroxidy a peroxid vodíku $H_2O_2$
- $M_2O_2+2\ H_2O\longrightarrow{2\ MOH+H_2O_2}$
- proto mají silné oxidační účinky
- peroxid vodíku se dál rozkládá na vodu a atomový kyslík
- peroxid sodný $Na_2O_2$
- používá se jako bělící prostředek
Hyperoxidy $MO_2$
- jsou barevné a paramagnetikcké
- jejich opatrným termickým rozkladem lze připravit seskvioxidy $M_2O_3$
- stechiometricky se jedná o peroxid-dihyperoxidy $[(M^+)_4(O_2^{2-})(O_2^-)_2]$
- ve vodě se rozkládají na peroxid vodíku, příslušný hydroxid a kyslík
Ozonidy $MO_3$
- jsou červené
- lze je extrahovat kapalným amoniakem z produktů reakce ozonu s bezvodnými hydroxidy za nízké teploty
- rozkládají se na hyperoxidy a kyslík
Hydroxidy $MOH$
- patří mezi laboratorní i průmyslové chemikálie
- jsou to velmi silné báze
- vyrábějí se elektrolýzou vodných roztoků halogenidů
- difragmová metoda
- používá se železná katoda
- brání difúzi chloru do katodového prostoru
- u katody roste koncentrace aniontů $OH^-$ a kationtů $M^+$
- amalgamová metoda
- používá se katoda z rtuťi
- rtuť vytváří s přicházejícími kationty $M+$ amalgamy
- ty se potom hydrolizují za vzniku hydroxidů
- zvažuje se znovu zavedení kaustifikace
- je to výroba z alkalických uhličitanů vodnou suspenzí $Ca(OH)_2$
- $M_2CO_3+Ca(OH)_2\longrightarrow{CaCO_3}+2\ NaOH$
- používá se při získávání vodného hydrátu hydroxidu lithného
- hydroxid sodný $NaOH$
Hydridy $MH$
- stálost klesá od lithia dolů
- jsou na vzduchu samozápalné
- reagují se vzdušnou vlhkostí
- používají se jako redukční činidla
- průmyslově se vyrábí hydrid lithný $LiH$ a hydrid sodný $NaH$
- používají se na výrobu stálejších redukčních činidel
- tetrahydridohlinitan lithný, tetrahydridoboritan sodný
Sloučeniny s dusíkem
- v amoniaku se alkalické kovy rozpouští za vzniku modrého roztoku
- rozpouštění probíhá disociací atomu kovu na kation $M^+$ a elektron
- elektron je solvatován amoniakem
- takový roztok je velmi nestabilní a pomalu se rozpadá na vodík a amid $MN_3$
- roztoky amidů alkalických kovů mají velmi dobré redukční účinky
- používají se k redukci organických látek
- dokáží také redukovat kyanokomplexy některých kovů
- $K_2[Ni(CN_4)]+2\ K\longrightarrow{K_4[Ni(CN)_4]}\ \ \ (v\ NH_3(l))$
- imid lithný $LiNH$ je jediný známý imid alkalického kovu
Soli
Příprava
- lze je připravit:
- neutralizační reakcí příslušné kyseliny a hydroxidu
- rozpouštěním oxidů v kyselinách
- reakcí kyselého oxidu s hydroxidem
- většinou se provádí ve vodných roztocích
- obdobně mohou probíhat i v taveninách
Halogenidy $MX$
- chlorid sodný $NaCl$
- používá se v potravinářském průmyslu ke konzervaci potravin
- jeho doporučená denní dávka je 3-4 g
- většina lidí konzumuje až 10 g denně
- nadbytek vede k rozvoji kardiovaskulárních chorob
- fyziologický roztok
- je to vodný roztok chloridu sodného o molární koncentraci $0.154\ mol\cdot{dm^{-3}}$
- je izotonický s lidskou krví
- jodid draselný $KI$
- přidává se do kuchyňské soli v oblastech, kde je v půdě málo jodu
Sulfidy $M_2S$
- jsou dobře rozpustné ve vodě
- hydrolyticky reagují zásaditě
- snadno se oxidují na thiosírany
- jejich varem vznikají polysulfidy
Dusičnany (ledky) $MNO_3$
- při vyšších teplotách se rozkládají na dusitany a kyslík
- při dalším zvyšování teploty se rozkládají na oxidy, dusík a kyslík
- dusičnan sodný $NaNO_3$
- vyskytuje se v chilském ledku
- byl významným dusíkatým hnojevem
- je hlavní surovinou pro výrobu kyseliny dusičné
- jeho konverzcí chloridem draselným lze získat dusičnan draselný
- dusičnan draselný $KNO_3$
- patří mezi významná oxidační činidla
- používá se jako hnojivo
Dusitany $MNO_2$
- jsou to bílé krystalické látky
- jsou hygroskopické a dobře rozpustné ve vodě
- dusitan sodný $NaNO_2$
- výrabí se záváděním oxidů dusíku do roztoku uhličitanu sodného
- používá se
- k výrob, barviv
- jako inhibitor koroze
- ke konzervaci masa
Uhličitany $M_2CO_3$ a hydorgenuhličitany $MHCO_3$
- uhličitan sodný (soda) $Na_2CO_3$
- patří mezi nevýznamnější sloučeniny alkalických kovů
- vyrábí se Solvayovým způsobem
- do nasyceného roztoku choridu sodného (solanka) nasyceného amoniakem se zavádí oxid uhličitý
- vzniká hydrogenuhličitan sodný, který se termicky rozkládá
- $NaCl+H_2O+NH_3+CO_2\longrightarrow{NaHCO_3}+NH_4Cl\ 2\ NaHCO_3\longrightarrow{Na_2CO_3 + H_2O+CO_2}$
- používá se
- při výrobě skla
- v textilním a papírenském průmyslu
- hydrogenuhličitan sodný (jedlá soda) $NaHCO_3$
- je součást kypřících prašků
- používá se při překyselní žaludku k neutralizaci žaludečních šťáv
- uhličitan draselný (potaš) $K_2CO_3$
- používá se při výrobě mýdel a chemického skla
- uhličitan lithný
- rozkládá se jako jediný při teplotě 900°C na oxid kovu a oxid uhličitý
- ostatní uhličitany se nerozkládají, pouze taví
Sírany $MSO_4$
- síran sodný $NaSO_4$
- užívá se jako projímadlo
- Glauberova sůl - $NaSO_4\cdot{10\ H_2O}$
Fosforečnany $M_3PO_4$ a hydrogenfosforečnany $M_2HPO_4$ a $MH_2PO_4$
- fosforečnany sodné $Na_3PO_4,Na_2HPO_4, NaH_2PO_4$
- vytvářejí pufrový systém v krevní plazmě
Soli organických kyselin, alkoholů a fenolů
- octan sodný $CH_3COONa$
- benzosulfonan draselný $C_6H_5SO_3K$
- etanolát lithný $C_2H_5OLi$
- fenolát sodný $C_6H_5ONa$
Organokovové sloučeniny
- karbidy $M_2C_2$ jsou málo běžné
- přímou reakcí kovu s ethenem poskytuje karbid jen lithium
- jsou známy také hydrogenkarbidy $MHC_2$
- $LiHC_2$ se využívá při syntéze vitaminu A
