Měď
- nachází se ve skupině I.B
- její elektronová konfigurace je $[Ar]4s^13d^{10}$
Zisk a výskyt mědi
- v přírodě se nachází především ve sloučeninách
- ryzí je velmi vzácná
- patří mezi biogenní prvky
- cytochromoxidasa
- hemocyanin
- je to látka, která přenáší kyslík v krvi měkýšů
- má bílkovinnou povahu
- má obdobnou funkci jako hemoglobin u savců
- v těle dospělého člověka se nachází někde vázáno přibližně 100 mg mědi
- člověk příjimá měď v potravě
- denní dávka by se měla pohybovat v rozmezí 3-5 mg
- nedostatek může způsobit některé formy anemie
- přebytek v důsledku špatného fungování jejího vylučování vede k vzniku Wilsonovy choroby
- výroba je složitá
- vzniká velmi mnoho jemně zrnitého odpadu
Vlastnosti mědi
- je to měkký, houževnatý kov načervenalé barvy
- je to ušlechtilý kov
- velmi dobře vede elektrikcý proud
- velká množství mědi se spotřebuje na výrobu elektrických vodičů
- je součástí řady slitin
- mosazi
- bronzy
- slitiny s cínem, často s příměsí zinku nebo olova
- alpaka
- přidává se i do mincovního stříbra a zlata
Vazebné možnosti mědi
- stálé jsou oxidační stavy $II$ a $I$
- atomy $Cu^I$ se snadno oxidují na $Cu^{II}$
- relativně dostupný, ale málo stálý je oxidační stav $III$ a $0$
Reakce mědi
- na vzduchu je poměrně stálá
- pokud je působení vzdušného oxidu uhličitého vystavena delší dobu, pokrývá se vrstvičkou uhličitanu měďnatého $CuCO_3$
- měděnka
- objevuje se na střechách starých budov
- při vyšších teplotách reaguje ochotně s řadou nekovů
- neslučuje se pouze s uhlíkem, vodíkem a dusíkem
- reaguje s koncentrovanými roztoky kyseliny dusičné a sírové
- nejlépe probíhá za zvýšené teploty
- $Cu+4\ HNO_3\longrightarrow{Cu(NO_3)_2}+2\ NO_2+2\ H_2O$
- $Cu+2\ H_2SO_4\longrightarrow{CuSO_4+2\ H_2O+SO_2}$
- se zředěným roztokem kyseliny dusičné nevzniká $NO_2$ ale $NO$, který se tímto způsobem přiravuje
- $3\ Cu+8\ HNO_3\longrightarrow{3\ Cu(NO_3)_2+2\ NO+4\ H_2O}$
- v koncentrovaných roztocích kyanidů se rozpouští za vývoje vodíků
Sloučeniny mědi
- oxid měďný $Cu_2O$
- je to červeně zbarvená látka
- připravuje se redukcí měďnatých solí
- je nerozpustný ve vodě
- v kyselinách se rozpouští za vzniku komplexních částic
- např. $Cu_2O+4\ HCl\longrightarrow{2\ H[CuCl_2]+H_2O}$
- u kyselin, kde anion není vhodným ligandem
- poměrně snadno oxiduje na oxid měďnatý
- oxid měďnatý $CuO$
- je to černě zbarvená látka
- připravuje se termickým rozkladem některých měďnatých sloučenin
- $2\ Cu(NO_3)_2\longrightarrow{2\ CuO+4\ NO_2+O_2}$
- je nerozputný ve vodě
- v kyselinách se rozpouští za vzniku
- vyzužívá se pro důkaz kationů $Cu^{2+}$ v analytické chemii
- slouží jako oxidovadlo
- hydroixd měďnatý $Cu(OH)_2$
- vzniká alkalizací roztoků měďnatých solí
- je poněkud amfoterní
- v kyselinách se rozpouští za opětovné tvorby měďnatých solí
- v koncentrovaných roztocích alkalických hydroxidů se částečně rozpouští za vzniku velmi nestabilních měďnatanů
- hydroxid měďny nebyl prokázán
- sulfid měďnatý $CuS$
- je to černě zbarvená látka
- je ve vodě nerozpustný
- působením vlhkého vzduchu se oxiduje za vzniku síranu měďnatého
- ten se používá jako insekticid a jako výchozí látka pro syntézu dalších sloučenin mědi
- halogenidy
- odvozují se z oxidačních stavů $I$ i $II$
- fluorid měďný se zatím nepovedlo přpravit
- jodid měďnatý $CuI_2$ je vysoce nestabilní látka
- podléhá vnitřnímu redoxnímu ději a rozpadá se na $CuI$ a $I_2$
- halogenidy měďné jsou bezbarvé a jsou známy jen v bezvodé formě
- halogenidy měďnaté jsou barevné a existují bezvodé i hydráty
- chloridy se používají jako katalyzátory
- chlord měďnatý $CuCl$ se navíc používá jako redukovadlo
- kyanidy a thikyanatany
- v oxidačním stavu $II$ jsou velmi nestálé
- rozpadají se podobně jako $CuI_2$
- v oxidačním stavu $I$ jsou to naopak vysoce stálé a odolné látky
- komplexy
- měď tvoří řadu komplexních sloučeniny v obou oxidačních stavech
- atomy $Cu^I$ dosahují koordinačních čísel 2, 3 a 4
- koordinace je buď lineární, trigonální nebo tetraedrická
- atomy $Cu^{II}$ dosahují koordinačních čísel 4, 5 a 6
- koordinace může být tetredrická, tetragonální, tetragonálně pyramidální, trigonálně bipyramidální, oktaedrická nebi tetragonálně bipyrimadální
- velmi výjimečně jsou koordinační čísla vyšší
- typickými ligandy jsou $Cl^-,Br^-,CN^-,SCN^-,OCN^-,S_2O_3^{2-},OH^-,NH_3$ a $H_2O$
- pentahydrát síranu měďnatého $CuSO_4\cdot{5\ H_2O}$
- modrá skalice
- používá se k výrobě celé řady měďnatých sloučeniny, k moření osiva a v galvanotechnice
- jeho struktura je poměrně složitá
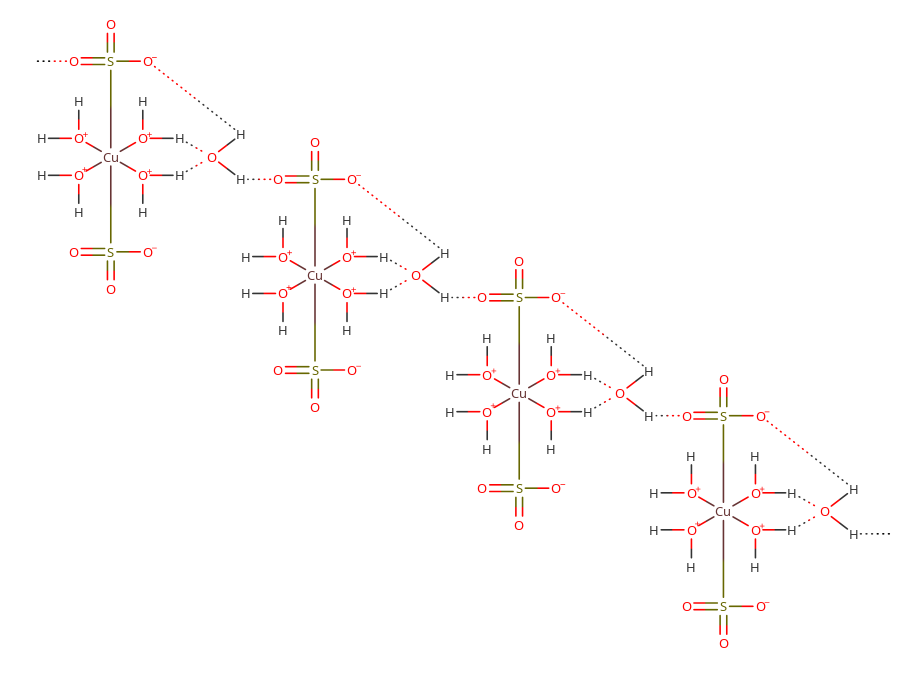
- čtyři molekuly vody tvoří kolem měďnatého kationtu čtverec
- nad a pod čtvercem jsou pak navázány síranové anionty pomocí jednoho kyslíku
- má tedy oktaedrickou koordinaci
- pátá molekula vody je prostřednictvím vodíkových můstků vázána k jedné z koordinoaných molekul vody a k síranovému aniontu dalšího komplexu
- vzniká tak krystalický mřížka
- při zahřívání přechází na trihydrát, později na monohydrát a nakonec vziká bezvodý bílý síran měďnatý $CuSO_4$
- při teplotách vyšších než 700°C se rozkládá na $CuO$ a $SO_3$
- hydroxid tetraaminměďnatý $[Cu(NH_3)_4] (OH)_2$
- ve vodném roztoku rozpouští celulosu
- používá se při výrobě umělého hedvábí
- organokovové sloučeniny
- vyšších oxidačních stavů než $II$ dosahuje měď v reakci se silnými oxidačními činidli
- třeba působením fluoru na směs $KCl$ a $CuCl_2$ při vyšší teplotě se tvoří hexafluoroměditan draselný $K_3[CuF_6]$
- měditany se tvoří reakcí v kyslíkové atmosféře za vysoké teploty
- např. $2\ K_2O+4\ CuO+O_2\longrightarrow{2\ KCuO_2}$
