Železo
- nachází se ve skupině VIII.B ve skupině triády železa
- jeho elektronová konfigurace je $[Ar]4s^23d^6$
Zisk a výskyt železa
- po kyslíku, křemíku a hliníku je to čtvrtý nejrozšířenější prvek na Zemi
- znali ho už staré civilizace
- ryzí železo se vyskytuje v přírodě spíše vzácně a je většinou meteorického původu
- jeho nejběžnějšími sloučeninami jsou oxidy a uhličitany
- je to mikrobiogenní prvek
- je nezbytný pro biosyntézu některých enzymů a chlorofylu
- je součástí některých bílkovin
- je součástí dýchacích enzymů (cytochromy)
- jsou to přenašeče elektronů při fotosyntéze a respiraci
- železo se cyklicky oxiduje $Fe^{2+}\leftrightharpoons{Fe^{3+}}$
- je součástí tetrapyrrolového barviva hemu
- hem je součástí respiračních pigmentů hemoglobinu, hemoerythrinu, myoglobin a chlorokruorinu
- jeho nedostatek se projevuje anemií
Výroba železa
- výroba se zdokonaluje už několik tisíciletí
- chemické děje při výrobě železa jsou velmi komplikované
Vysoká pec
- je to technologické zařízení válcovitého tvaru o průměru okolo 7 metrů
- její výška se pohybuje v rozmezí 25 až 30 metrů
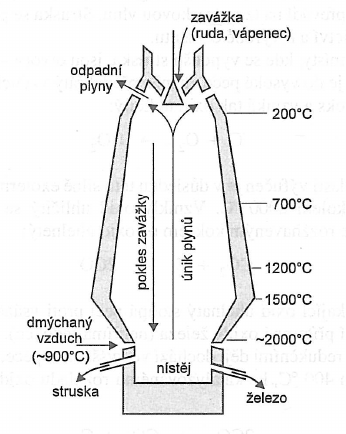
Kychta
- je to horní část pece
- slouží na přidávání vsázky do reakčního systému
- je tudy odváděn krychtový plyn
- teplota v této části pece je 100 - 500°C
- kychtový plyn
- je to opdadní plyn pro zpracování železné rudy
- obsahuje:
- dusík - 58-60%
- oxid uhelnatý $CO$ - 25-30%
- oxid uhličitý $CO_2$ - 8-12%
- vodík - 1.5-4%
- methan - 0.2-0.4%
- vsázka
- je to směs reaktantů
- obsahuje železnou rudu, koks a vápenec
Zóna 400 - 1000°C
- dochází k termickému rozkladu vápence
- $CaCO_3\longrightarrow{CaO+CO_2}$
- dochází i k nepřímé redukci železa
- vznikají nižší oxidy železa
- $3\ Fe_2O_3+CO\longrightarrow{2\ Fe_3O_4+CO_2}$
- $Fe_3O_4+CO\longrightarrow{3\ FeO+CO_2}$
- $FeO+CO\longrightarrow{Fe(s)+CO_2}$
- na konci řetězce reakcí vzniká houbovité pevné železo
- dále dochází k nauhličování železa
- uhlík difunduje do houbovitého železa a tvoří karbid triželeza $Fe_3C$
- dále podíl uhlíku ve směsi zvyšuje vznikající $CO$ a $CO_2$ a koks
- tento proces je velmi důležitý a dochází ke snižování bodu tání železa
- nejnižšího bodu tání (1130°C) dosáhne směs s obsahem uhlíku 4.3%
- zvyšováním koncentrace bod tání opět roste
Zóna 1000 - 2000°C
- dochází k příme redukci železa
- $FeO+C\longrightarrow{Fe(l)+CO}$
- vznikající železo je již kapalné
- opět dochází k nauhličování
Nístěj
- je to nejnižší část pece
- shromažďuje se zde kapalné železo
- vypouští se po několika hodinách odpichem
- při oxidaci se železo pokrýcá tenkou vrstvou strusky
- struska
- je produktem oxidace kapalného železa
- má menší hustotu než železo
- vzniká z přítomného oxidu vápenatého a oxidu křemičitého z rudy
- z pece se vypouští obdobně jako železo
- prudkým ochlazením se granuluje nebo se profukuje parou
- vzniká strusková vlna, která se používá ve stavebnictví a k výrobě cementu
Výfučny
- jsou umístěny nad shromaždištěm strusky
- do pece je jimi vháněn předehřátý vzduch
- dochází ke spalování koksu na oxid uhličitý
- $C+O_2\longrightarrow{CO_2}$
- v oblasti výfučen kvůli teté silně exotermní reakci teplota okolo 2000°C
- vzniklý oxid uhličitý se okamžitě redukuje uhlíkem na oxid uhelnatý
- $CO_2+C\longrightarrow{2\ CO}$
- vzniklý oxid uhelnatý stoupá pecí proti vsázce a redukuje v ní přítomné oxidy železa
- při teplotě okolo 400°C dochází ke katalyzovanému rozkladu oxidu uhelnatého
- $2\ CO\longrightarrow{CO_2}+C$
- reakce je katalyzovaná oxidy železa
- vznikající uhlík vniká do pórovitého povrchu rud a urychluje redukci
niklé surové železo se označuje jako litina
- obsahuje větši množství příměsí
- primárně uhlík, ale také křemík, mangan a fosfor
- nejdůležitější příměsí je uhlík
- způsobuje to jeho velkou křehkost
- nachází se ve formě grafitu a karbidu triželeza
- z velké části se musí dále zpracovávat na ocel
Výroba oceli
- dochází k regulaci obsahu uhlíku a odstranění nežádoucích přímesí ze surového železa
Zkujňování
- podstatou je oxidace obsažených příměsý
- provádí se s využitím kyslíku obsaženého v oxidech železa
- probíhá buď v konvertorech nebo v nístějových plamenných či elektrických indukčních pecích
- dochází k částečné oxidaci železa na oxid železnatý $FeO$
- ten se rozpouští do železa a oxiduje nežádoucí složky
- část uhlíku zoxiduje na oxid uhelnatý, který opouští taveninu
- mangan a křemík přechází na oxidy manganatý a křemičitý
- vytvoří strusku, která má nižší hustotu než roztavený kov
- fosfor se odstraňuje až později po snížení obsahu uhlíku
- pokud tavenina obsahuje zbytky uhlíku, musí se přidat nadbytek oxidu vápenatého, který převádí vznikající oxid fosforečný na fosforečnan vápanetý
- síra se váže na mangan ve směsi a následne substitucí na vápník
Dezoxidaxe
- ocel připravená zkujňováním nyní obsahuje oxidy železa, které zpsůobují její křehkost
- do oceli se přidávají slitiny ferromangan a ferrosilicium, které železo vytěsní a vytvoří vlastní oxidy, které se hromadí na povrchu taveniny
Úpravy oceli
Kování a válcování
- ovlivňuje základní mechanické vlastnosti
Legování
- je to vnášení příměsí do oceli prostřednictvím slitin železa
- vlastnosti se upravují podle přidávané slitinu a jejího množství
Kalení
- je to roztavení oceli na předepsanou teplotu a následné prudké ochlazení
- zvyšuje to tvrdost oceli, ale zapřičiňuje to křehkost
Popouštění
- je to zahřívaní oceli na předepsanou teplotu ve speciálních lázních
- dodá to oceli tvrdost a pružnost
Povrchové úpravy
- Cementace
- spočívá ve zvyšování obsahu uhlíku v povrchové vrstvě oceli
- upravovaný předmět se vloží do cementační směsi
- je to směs dřevěného uhlí, uhličitanu vápenatého a barnatého
- směs se zahřívá na teplotu 900°C
- uhlík difunduje do povrchové vrstvy a učiní ocel tvrdší
- Nitridování
- provádí se zahříváním oceli v prostředí amoniaku
- vzniká vrstva nitridu dvojželeza $Fe_2N$
Vlastnosti železa
- čisté železo je poměrně měkký kujný kov stříbřité barvy
- taje při teplotě 1535°C
- vyskytuje se ve třev alotropických modifikacích
- $\alpha-Fe$
- je stabilní v teplotách do 906°C
- $\gamma-Fe$
- je stabilní při teplotách od 906°C do 1401°C
- $\delta-Fe$
- je stabilní při vyšších teplotách
- teplota má vliv na feromagnetické vlastnosti
- při teplotě do 768°C je silně magnetické po vložení do magnetického pole
- při vyšších teplotách tuto vlastnost ztrácí
Vazebné možnosti železa
- atomy železa se nejčastěji stabilizují v oxidačních stavech $II$ a $III$
- jednoduché železnaté soli jsou dobrými redukovadli, protože atom $Fe^{II}$ snadno přechází na atom $Fe^{III}$
- u komplexních částic je tomu naopak
- v obou oxidačních stavech dochází ve sloučeninách ke koordinaci vazeb na tetraedr (hybridizace $sd^3$) nebo okaedr (hybridizace $sp^3d^2$)
- krom oxidačního stavu $II$ a $III$ se může železo stabilizovat i v oxidačním stavu $VI$
- sloučeniny obsahující takové železo jsou extrémně silná oxidační činidla
- méně často se železo vyskytuje ve stavech $V,IV,I,0$ a $-II$
Reakce železa
- je to neušlechtilý kov
- s kyselinami reaguje za současného vývoje vodíku
- alkalické hydroxidy na něj nepůsobí
- za zvýšené teploty se slučuje s celou řadou nekovů
- s mnohými kovy poskytuje intermetalické sloučeniny nebo slitiny
Koroze (rezavění)
- železo podléhá působení vzdušného kyslíku a vlhkosti
- je to velmi vážný problém
- jedná se o elektrochemický děj
- vodivost je zajištěna elektrolytem $FeSO_4$, který vzniká za účasti atmosférického oxidu siřičitého
- $4\ Fe+3\ O_2+2x\ H_2O\longrightarrow{2\ Fe_2O_3\cdot{x\ H_2O}}\ \text{rez}$
- probíhá velmi dlohou a konstantní rychlostí
- před korozí se železo chrání různými nátěry nebo galvanickým pokovením
- na povrchu železa vytvoříme vrstvičku, která zamezí kontaktu se vzduchem
- fosfátování
- je to povrchová úprava železa
- železný předmět se rozehřátý do rudého žáru ponoří do kyseliny fosforečné obsahující ionty některých kovů
- na předmětu se vytvoří vrstvička
- pokud jsou v železe malé trhlinky nebo jamky, na nátěr je již pozdě
- v jamkách a trhlinách se tvoří dobře přilnavá vrstva rzi a reakční systém se uzavře
- pokud je nátěr jen jemně porušen, může to způsobit korozi pod ním
Sloučeniny železa
- oxid železnatý $FeO$
- je to černá, práškovitá látka
- je stálý pouze při vyšších teplotách (nad 575°C)
- pri nižších teplotách dochází k jeho disproporcionaci
- $4\ FeO\longrightarrow{Fe+Fe_3O_4}$
- prudkým ochlazením vznikají jeho metastabilní fáze
- vždy obsahují menší množství železa
- je relativně bazický
- v kyselinách se dobře rozpouští za vzniku železnatých solí pokud není přítomen kyslík
- v takovém připadě by se vzniklé sloučeniny rychle zoxidovali na soli železité
- jeho tavení s alkalickými hydroxidy ovšem vytváří nestálé železnatany
- nestálost je důsledkem slabě amfoterního charakteru oxidu
- má nestechiometrické složení způsobené přítomností atomů $Fe^{III}$
- oxid železitý $Fe_2O_3$
- je to červená látka
- je známý v několika modifikacích
- $\alpha-Fe_2O_3$
- vyskytuje se v podobě rudy hematitu
- využívá se jako pigment a při výrobě umělých granátů
- $\gamma-Fe_2O_3$
- je nestabilní
- připravuje se opatrnou oxidací podvjoného oxid železa
- používá se při výrobě magnetických pásek
- v kyselinách se rozpouští za vzniku železitých solí
- jeho tavením v jiných oxidech vznikají podvojné oxidy
- používá se jako pigment
- oxid železnato-železitý $FeO\cdot{Fe_2O_3}$ (případně $Fe_3O_4$)
- připravuje se částečnou oxidací oxidu železnatého
- v přírodě se vyskytuje ve formě magnetitu
- používá se na výrobu elektrod pro některé tavné elektrolýzy
- dá se použít jako mírné oxidovadlo, katalyzátor
- může sloužit k přípravě velmi čistého železa
- hydroxid železnatý $Fe(OH)_2$
- je to bílá látka
- je stálý jen za nepřítomnosti kyslíku nebo oxidovadel
- chová se podobně jako $FeO$
- vzniká při alkalizaci roztoků železnatých solí
- hydroxid železitý $Fe(OH)_3$
- je to rezavě červená látka
- chová se podobně jako $Fe_2O_3$
- vzniká obdobně jao $Fe(OH)_2$
- používá se k čiření vody a k výrobě jiných sloučenin železa
- halogenidy $Fe^{II}$
- připravují se vedením příslušného halogenovodíku přes zahřáté železo nebo reakcí železa s příslušnou halogenovodíkovou kyselinou
- jsou rozpustné ve vodě
- z vodných roztoku krystalizují ve formě hydrátů
- halogenidy $Fe^{III}$
- je možné je připravit přímou reakcí prvků
- jsou dobře rozpustné ve vodě
- ve vodě hydrolizují za vzniku komplexních částic
- chlorid železitý $FeCl_3$
- sublimuje
- v parách se vyskytuje ve formě dimeru $Fe_2Cl_6$
- je sestaven ze dvou tetraedrů sdílejících jednu hranu
- tvoří řadu hydrátů
- používá se k leptání kovů a tištěných spojů
- to se uplatňuje v elektrotechnice
- používá se v organické syntéze barviv a dále v Friedelových-Craftsových snytéz
- sulfid železnatý $FeS$
- připravují se přímou syntézou prvků
- existuje také disulfid železnatý $FeS_2$
- existence sulfidu železitého nebyla prokázána
- karbid triželeza $Fe_3C$
- tvoří se rozpouštěním uhlíku v roztaveném železa
- je přítomen v polykrystalické struktuře oceli
- velmi ovlivňuje její chemické vlastnosti
- síran železnatý $FeSO_4$
- bezvodý je bílí
- z vodných roztoků krystalizuje ve formě heptahydrátu $FeSO_4\cdot{7\ H_2O}$ - zelené skalice
- přidává se do dřeva na ochranu proti hnilobě
- uplatňuje se při výrobě barviv
- používá se k výrobě inkoustu a proti plevelu
- se sírany alkalických vznikají podvojné soli $M_2^IFe(SO_4)_2\cdot{6\ H_2O}$
- Mohrova sůl $(NH_4)_2Fe(SO_4)_2\cdot{6\ H_2O}$
- vzniká sloučením síranu železnatého a síranu amonného
- používá se v analitické chemii
- je to nejstálejší sloučenina železa
- uhličitan železnatý $FeCO_3$
- v přírodě se nachází ve formě sideritu
- pokud přes tento minerál projde voda obsahující oxid uhličitý, vznikne hydrogenuhličitan železnatý $Fe(HCO_3)_2$
- je obsažen v některých minerálních vodách
- způsobuje jejich vysoký obsah železa
- kyslíkem se snadno oxiduje a přechází na hydratovaný oxid železitý
- působí narezavělý zákal minerálních vod
- železany
- jsou to nestabilní červenofialové látky
- jsou stálé pouze ve velmi zásaditých vodných roztocích
- tvoří se v oxidujících bazických taveninách
- např. $Fe_2O_3+3\ KNO_3+4\ KOH\longrightarrow{2\ K_2FeO_4+3\ KNO_2+2\ H_2O}$
- jsou to jedy z nejmohutnějších oxidačních prostředků
- jejich termickým rozkladem se dají připravit některé další sloučeniny, třeba železičnany nebo železičitany
- komplexy
- železo tvoří velké množství rozmanitých komplexů
- komplexní sloučeniny obsahující železo v oxidačním stavu vyšším než $III$ nejsou známi
- nejběžnější je u nich koordinační číslo 6, méně často 4 a 5
- nejběžnějšími ligandy jsou $CN^-,SCN^-,NO^+,NO_2^-,H_2O,CO,SO_3^{2-},Cl^-,F^-,Br^-$ a některé další
- reakcí železa s thiokyanatany (primárně $KSCN$) vzniká krvavě barevný roztok
- využívá se toho v analytické chemii k důkazu $Fe^{3+}$
- krom thiokynatanu železitého $Fe(SCN)_3$ se v něm vyskytuje řada izolovatelných komplexů
- $[Fe(SCN)_4]^-,[Fe(SCN)_6]^{3-},[Fe(H_2O)_5(SCN)]^{2+}$
- hexakyanoželezitan draselný $K_3[Fe(CN)_6]$
- je to červená krevní sůl
- ligandy $CN^-$ jsou koordinovány labilně
- trihydrát hexakyanoželeznatanu draselného $K_4[Fe(CN)_6]\cdot{3\ H_2O}$
- je to žlutá krevní sůl
- je mnohem stabilnější než hexakyanoželzitan draselný
- připravuje se působením přebytečného kyanidu v koksárenském plynu na vodné ammoniakální roztoky síranu železnatého
- vzniklý komplex se odděluje srážením vápenatou solí a konverzí draselnou solí
- komplexní anionty těchto dvou látek reagují s kationty železitými a železnatými za vzniku barviv
- berlínská modř $Fe_4[Fe(CN)_6]_3\cdot{x\ H_2O}$
- anionty hexakyanoželeznatanové reagují s kationty železitými
- Thrunbullová modř $Fe_3[Fe(CN)_6]\cdot{x\ H_2O}$
- anionty haxykyanoželezitanové reagují s zationty železnatými
- používali se na výrobu inkoustu a nátěrových hmot
- karbonyly
- vytváří karbonyly $[Fe(CO)_5],[Fe_2(CO)9]$ a $[Fe_3(CO){12}]$
- oxidační číslo železa v těchto sloučeninách je $0$
- pentakarbonyl železa $[Fe(CO)_5]$
- je to prudce jedovatá kapalina
- jeho molekula ma trigonálně bipyramidální strukturu
- vyrábí se přímou reakcí
- je výchozí sloučeninou pro výrobu velmi čistého železa, které se vyrábí jeho termickým rozkladem
- organokovové sloučeniny
