- nepřechodné prvky
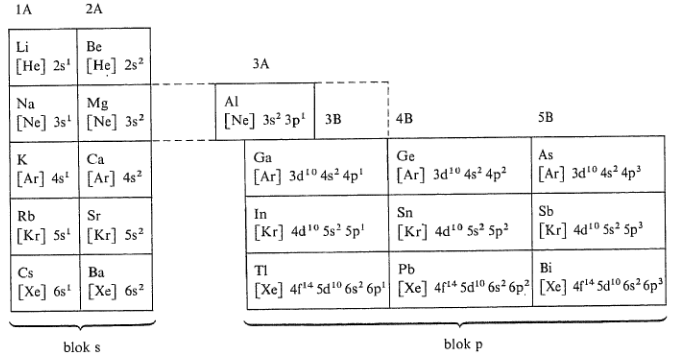
- s-prvky
- jsou to prvky $I.A$ a $II.A$ skupiny periodického systému
- jsou to kovy, až na vodík
- většina je silně elektropozitivní
- mají silný bazický charakter
- p-prkvy
- jsou to prvky $III.A$ až $VIII.A$ skupiny periodického systému
- jsou rozděleny diagonálou od boru po astat
- nad diagonálou jsou nekovy a polokovy
- pod diagonálou jsou prvky spíše s kovovým charakterem
- je to pouze přibližné rozdělení
Chemická periodicita
Periodicita oxidačních čísel
- maximální oxidační číslo odpovídá počtu elektronů ve valenční sféře a tedy i čísle skupiny
- minimální oxidační číslo lze odovodit pro prvky $IV.A$ až $VII.A$ skupiny
- je rovno $8-$číslo skupiny
Odlišné vlastnosti prvků 2. periody
- platí od lithia po fluor
- jsou nejvíce pozorovatelné ve $VI.A$ až $VII.A$ skupině
- liší se v možných oxidačních stavech, hybridizaci v analogických sloučeninách, odlišná reaktivita
- je to způsobeno absencí volných orbitalů d
Diagonální podobnost
- platí mezi lithiem a hořčíkem, berylliem a hliníkem a mezi borem a křemíkem
- tyto prvky mají blízké hodnoty elektronegativit a obdobné hustoty náboje na povrchu iontu
Změny oxidačního čísla o dva stupně
- většina p-prvků může vytvářet sloučeniny, ve kterých nabývá různých oxidačních čísel
- ta se liší o dvě jednotky v důsledku tvorby elektronovůch párů
Vliv inertního páru
- projevuje se především u kovů 6. periody
Změny v elektropozitvním a elektronegativním charakteru
- platí ve skupinách a periodách
- v každé skupině roste elektropozitivní charakter s rostoucím protonovým číslem
- souvisí to se zvyšujícím se kovovým charakterem
- v každé skupině klesá stálost vyšších oxidačních čísel a soupá stálost nižších oxidačních čísel
- v každé periodě vzrůstá elektronegativní charakter s roustoucím protonovým číslem
Změny acidobazického charakteru prvků a jejich oxidů
- úzce souvisí s kovovým či nekovovým charakterem prvků
- oxidy prvků s elektropozitivním charakterem tvoří zásady
- oxidy prvků s elektronegativním charakterem tvoří kyseliny
- ve skupině stoupá zásadotvorný charakter a v periodě stoupá kyselinotvorný charakter oxidů
- řada kovů v nízkém oxidačním čísle tvoří zásady ve vyšším oxidačním čísle oxidačním čísle