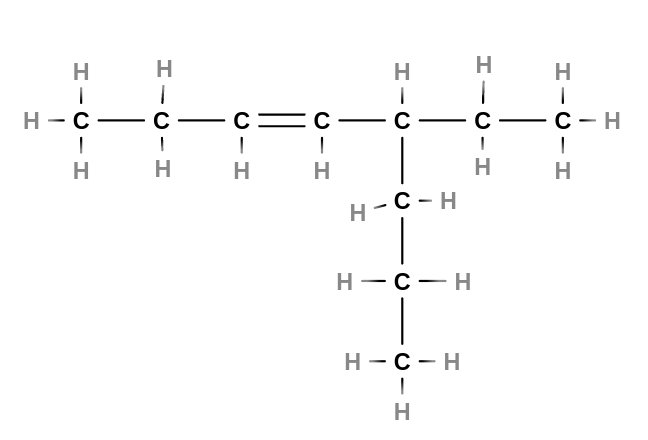
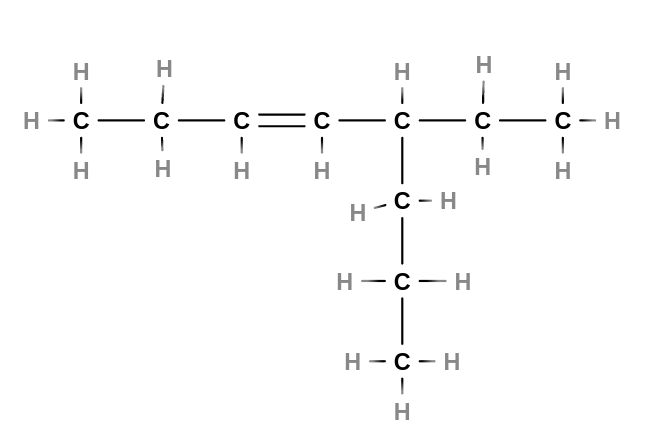
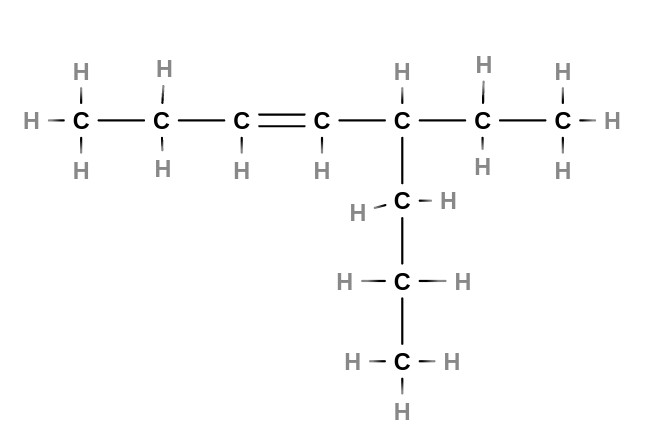
- Alkeny
- jsou nenasycené uhlovodíky s jednou dvojnou vazbou v řetězci
- tvoří homologickou řadu s obecným vzorcem $C_nH_{2n}$
- Polyeny
- jsou nenasycné uhlovodíky se dvěma nebo více dvojnými vazbami
- Uspořádání dvojných vazeb
- kumulované
- vedle sebe
- např.: buta-1,2-dien
- izolované
- alespoň dvě jednoduché vazby mezi dvojnými vazbami
- např.: hexa-1,4-dien
- konjugované
- střídání dvojné a jednoduché vazby
- např.: buta-1,3-dien
- kumulované
- Cykloalkeny
- jsou cyklické nenasycené uhlovodíky s jednou nebo více dvojnými vazbami
Nomenklatura
Nomenklatura alkenů
Tvorba názvu
- určíme hlavní řetězec
- očíslueme řetěz
- utvoříme název
Tvorba vzorce
- obdobně jako u alkanů
Nomeklatura polyenů
Tvorba názvu
- obdobně jako u jednoduchých alkenů
- k suffixu -en se přidává násobná předpona podle počtu dvojných vazeb
- např.:
- $CH_2=C=CH-CH=CH_2$ - penta-1,2,4-trien
Tvorba vzorce
- obdobně jako u jednoduchých alkenů
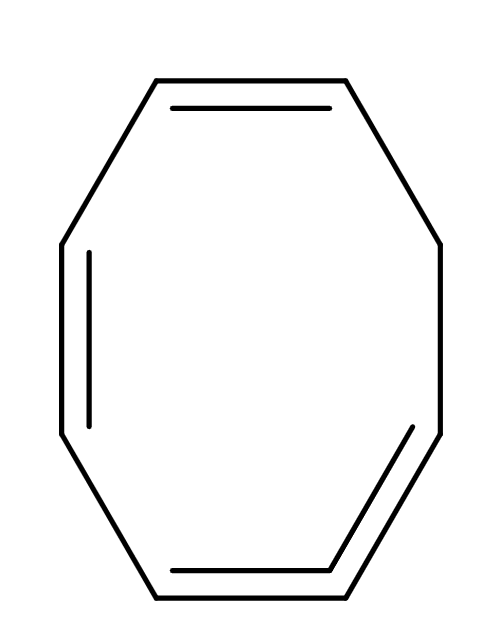
Nomenklatura cykloalkenů
- je obdobná nomenklatuře cyklalkanů s pravidly pro nomenklaturu jednoduchých alkenů a polyenů
- např.:
Fyzikální vlastnosti alkenů a cykloalkenů
- stejné jako u alkanů
- větší počet konjugovaných vazeb způsobuje zbarvení
Chemické vlastnosti alkenů a cykloalkenů
- jsou reaktivnější než alkany
Dvojná vazba
- ovlivňuje reaktivitu
- atomy uhlíku mají hybridizaci $sp^2$
- tvoří ji elektrony vazby $\sigma$ a elektrony vazby $\pi$
- $\sigma$ elektrony jsou na spojnici jader a tvoří pevnou vazbu
- $\pi$ elektrony tvoří elektronový oblak nad a pod spojnici jader
- jsou snadněji polarozovatelné
- snáze se štěpí
Reakce alkenů
Adiční reakce
Elektrofilní adice
- Markovnikovo pravidlo
Elektronegativní část činidla se váže na ten atom uhlíku dvojné vazby, které nese méně vodíkových atomů.
- Hydrohalogenace
- adice halogenovodíku
- vzniká halogenalkan
- $R-CH=CH_2+H-X\longrightarrow{R-CH(X)-CH_3}$
- Hydratace
- adice vody
- vzniká alkohol
- $R-CH=CH_2+H-OH\longrightarrow{R-CH(OH)-CH_3}$
- Halogenace
- adice halogenu
- při přiblížení k $\pi$ vazbě se vazba $X-X$ heterolyticky štěpí a vznikají ionty
- vzniká dihalogenalkan
- $R-CH=CH_2+X_2\longrightarrow{R-CH(X)-CH_2X}$
- může probíhat i radikálově iniciací UV zářením
Radikálová adice
- při iniciaci se činidlo ($AB$) štěpí na dva radikály působením externího vlivu
- $A-B\longrightarrow{A\cdot}+B\cdot$
- při propagaci dochází k napadení substrátu radikálem v místě dvojné vazby
- vzniká substrátový radikál
- $R_2-C=C-R_2+A\cdot\longrightarrow{R_2AC-C\cdot-{R_2}}$
- při terminace substrátová radikál atakuje molekulu činidla
- vzniká tak nový uhlovodík a činidlo se částečně obnoví
- $R_2AC-C\cdot-R_2+A-B\longrightarrow{R_2AC-CBR_2}+A\cdot$
- $A\cdot+B\cdot\longrightarrow{A-B}$
- Katalytická hydrogenace
- nesnáze probíhá u dvojných vazeb na konci řetězce
- vzniká alkan
- $R-CH=CH_2+H_2\stackrel{Ni/Pt}{\longrightarrow}R-CH_2-CH_3$
Oxidace roztokem $KMnO_4$
- používá se k důkazu násobných vazeb
- fialový roztok se odbarví
- vznikají buď dvojsytné alkoholy nebo karboxylové kyseliny
- $R-CH=CH_2\stackrel{KMnO_4}{\longrightarrow}R-CH(OH)-CH_2OH\ R-CH=CH_2\stackrel{KMnO_4}{\longrightarrow}R'-COOH+CH_3-COOH$
Polymerizace
- vznikají polymery - plasty
- používají se v lékařství na hadičky, trubičky, injekční stříkačky, umělé cévy apod.
- např.: polyethen
- $n\ CH_2=CH_2\longrightarrow{-[CH_2-CH_2]_n-}$
Substituční reakce
- probíhají jen za vysokých teplot
- subtituce je radikálová
Izomerace alkenů
- probíhá za katalytického působení silných kyselin
- dochází k přesunu dovjné vazby nebo přestavbě řetězce
Chemické vlastnosti polyenů
- s kumolovanými a izolovanými vazbami se chovají stejně jako jednodušší alkeny
- kumulované polyeny jsou málo stabilní a často se přesmykem přeměňují na alkyny
Chemické vlastnosti polyenů s konjugovanými dvojnými vazbami
Delokalizace $\pi$-elektronů
- atomy uhlíku mají všechny hybridizaci $sp^2$
- hybridizované orbitaly leží všechny v jedné rovině a navzájem spolu interagují
- $\pi$-elektrony se volně pohybují
Stabilizace resonancí
- způsobuje větší než očekávanou stabilitu
- lze rozeznat mnoho mezomerních struktur
- žádný rozeznatelný rezonanční stav molekuly nezachycuje přesný stav molekuly
Reakce
- Adice
- probíhá dvěma způsoby
- 1,2-adice
- $R-CH_2=CH-CH=CH_2+X_2\longrightarrow{R-CH_2=CH-CH(X)-CH_2(X)}$
- 1,4-adice
- $R-CH=CH-CH=CH_2+X_2\longrightarrow{R-CH(X)-CH=CH-CH_2(X)}$
- Polymerizace
- může probíhat radikálovým nebo elektrofilním mechanismem
- je důležitá pro výrobu důležitách plastů
Výroba
- je založena na eliminačních reakcích
- dochází k odštěpení substituentů na dvou sousedních atomech uhlíku
Dehydrogenace
- z nasycených uhlovodíků
- jako katalyzátor se používá směs oxidů hlinitého a chromitého
- teplota reakce se pohybuje v rozmezí 500 - 1000 °C
Dehydratace
- z alkoholů
- s alkoholem zreaguje kyselina sírová za vzniku kyseliny alkylsírové a vody
- termickým rozkladem kyseliny alkylsírové vzniká zpátky kyselina sírová a alken
Dehydrohalogenace
- z alkylhalogenidu
- a alkoholickým roztokem alkalického hydroxidu zreaguje alkalhalogenid za odštěpení molekuly halogenovodíku
- vzniká sůl halogenovodíkové kyseliny a alkalického hydroxidu
Zástupci
Ethen
- $CH_2=CH_2$, ethylen
- je to bezbarví plyn
- získává se při zpracování ropy
- jeho směs se vzduchem je výbušná
- vyrábí se z něj mnoho dalších organických sloučenin
Propen
- $CH_3-CH=CH_2$, propylen
- je jedním z produktů při zpracování ropy
- používá se pro výrobu polymeru
Buten
- má čtyři izomery:
- but-1-en
- cis-but-2-en
- trans-but-2-en
- 2-methylpropen
- slouží jako surovina pro výrobu leteckého benzínu
- buteny se používají k výrobě syntetického kaučuku
Isopren
- 2-methylbuta-1,3-dien
- je základní složkou přírodního kaučuku
- je základní složkou přírodního kaučuku o kaučuku
Isopren
- 2-methylbuta-1,3-dien
- je základní složkou přírodního kaučuku
- je základní složkou přírodního kaučuku