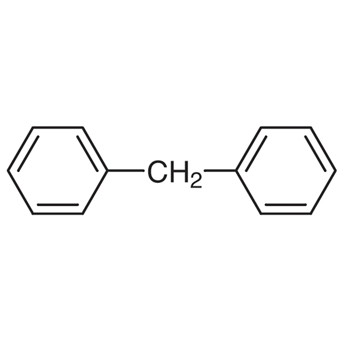
Benzen
- nejjednodušší a netypyčtější aren
- molekulový vzorec: $C_6H_6$
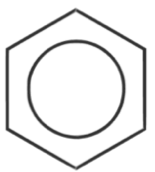
- strukturní vzorec:

- přesně neodpovídá skutečnosti
- zobrazuje cyklohexa-1,3,5-trien
- používá se stále
- přesně neodpovídá skutečnosti
Struktura benzenu
- je to cyklický uhlovodík
- obsahuje systém konjugovaných dvojných vazeb
- všechny atomy uhlíku mají hybridní orbitaly $sp^2$
- všechny atomy uhlíku mají jeden nehybridizovaný orbital $2p$
- jsou navzájem paralelní a kolmé k rovině uhlíkových atomů
- $\pi$-elektrony se mohou volně pohybovat
- všechny vazby v benzenu jsou rovnocené a stejně dlouhé
Vlastnosti benzenu
- delokalizované $\pi$-elektrony dodávají systému větší stabilitu
- nižší reaktivita
- delokalizace elektronů snižuje energii molekuly
- delokalizační energie (resonanční energie)
- úbytek energie
Aromatický charakter
- vlastnosti odvozené od benzenu
- určují podmínky pro aromatické sloučeniny
- Vlastnosti
- obsahuje cyklický systém konjugovaných dvojných vazeb
- molekula je planární
- obsahuje $4n+1\ \pi$-elektronů
- Hückleovo pravidlo
- $n$ nabývá hodnotě $0$ a kladných celočíselných hodnot
- pro benzen je $n=1$ jí jasnou a příjemnou vůni
Rozdělení arenů
- Monocyklické areny
- obsahují jedno benzenové jádro
- Polycyklické areny
- obsahují více než jedno benzenových jader
- mají zvláštní číslování
- pojmenovávají se triviálními názvy
- kondenzované polycyklické areny
- benzenová jádra sdílí dva uhlíky
- izolované polycyklické areny
- benzenová jádra sdílí jeden uhlík
Nomenklatura arenů
- názvy jednodušších arenů jsou odvozeny od benzenu nebo jsou triviální
- používání triviálních názvu je velmi časté
Určení polohy dvou substituentů
- pro určení polohy subtituentů používáme lokanty nebo speciální prefixy
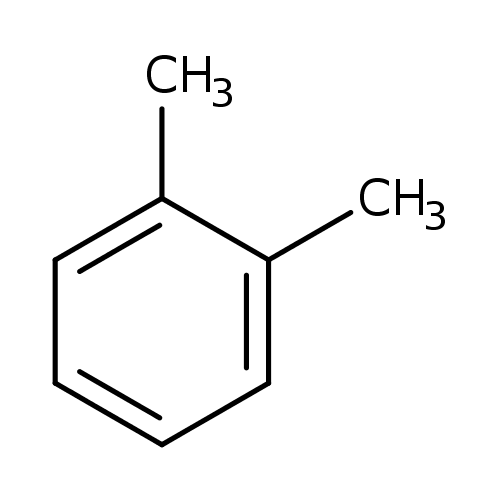
Poloha ortho
Poloha meta
Poloha para
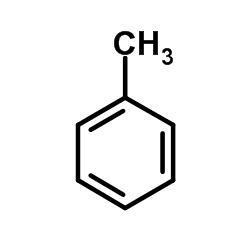
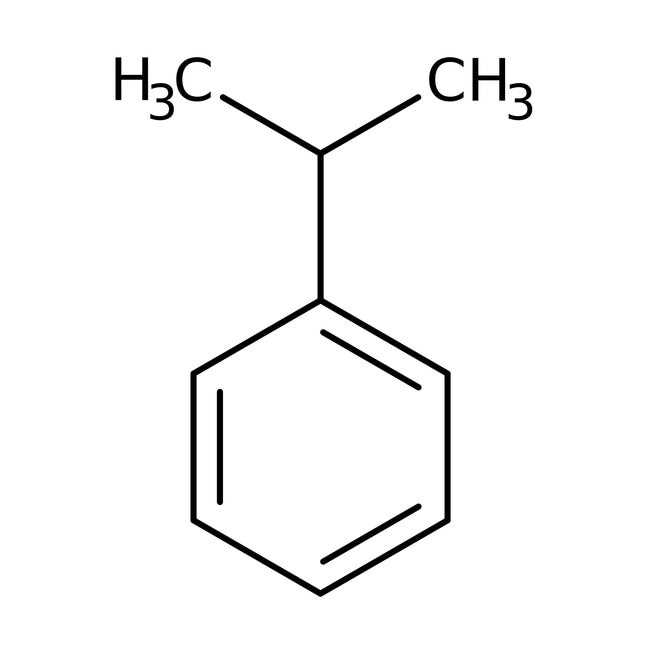
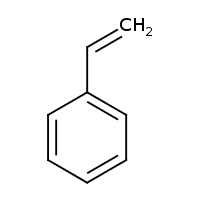
Alkyl- a alkenylbenzeny
- obsahují jeden aromatický kruh
- např.:
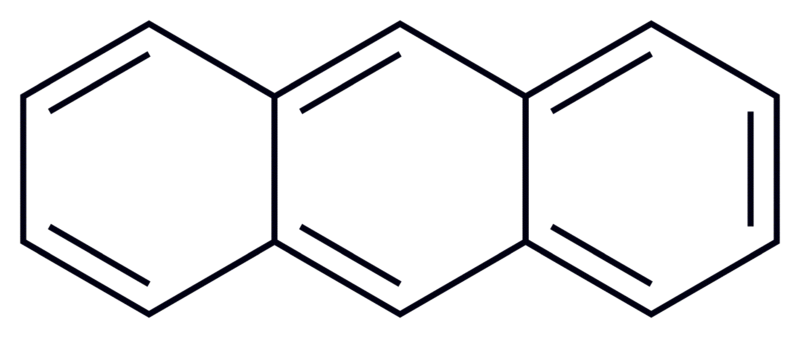
Areny s kondenzovanými aromatickými kruhy
- obsahuje více než jeden aromatický kruh
- sousední kruhy mají společné atomy uhlíku
- mají triviální názvy
- např.:

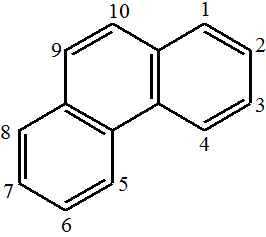
Areny s nekondenzovanými aromatickými kruhy
Aryly
Fyzikální vlastnosti arenů
- mají charakteristický zápach
- jsou hořlavé a toxické
- jsou nerozpustný ve vodě
- kapalné areny (benzen, toluen, xyleny) se používají k výrobě organických rozpouštědel
- areny s kondenzovanými aromatickými kruhy jsou pevné a snadno sublimují
Chemické vlastnosti arenů
- jsou stabilnější než klasické nasycené uhlovodíky
Reakce arenů
Elektrofilní substituce
- Obecně
- elektrofilní činidlo napadá benzenový kruh
- vzniká $\pi$-komplex
- ten se mění na $\sigma$-komplex
- elektrofilní činidlo se váže na jeden atom kruhu
- je narušena aromaticita
- uvolní se kation $H^+$
- aromaticita se obnoví
- vzniká substituční derivát
- přítomné substituenty v látce mohou ovlivnit substituci dalších
- Substituenty I. řádu
- řídí vstup dalšího substituentu do polohy ortho nebo para
- jsou to alkyly a skupiny s volným elektronovým párem ($-OH,-NH_2,-OR$, halogeny)
- působí +M efektem
- zvyšují elektronovou hustotu v polohách ortho a para
- Substituenty II. řádu
- řídí vstup dalšího substituentu do polohy meta
- působí -M efektem
- Substituenty I. řádu
- Halogenace
- vznikají halogenderiváty ($Ar-X$)
- podle podmínek vstupuje halogen do postranního řetězce
- vazba $X-X$ se štěpí heterolyticky
- elektrofilním činidlem je $X^+$
- Nitrace
- provádí se působením nitrační směsi
- koncentrovaná kyselina dusičná a kyselina sírová
- vznikají nitrosloučeniny
- elektrofilním činidlem je nitroniový kation $^+NO_2$
- vznik nitroniového kationtu: $HO-NO_2+H^+\longrightarrow{^+}NO_2+H_2O$
- provádí se působením nitrační směsi
- Sulfonace
- provadí se působením koncentrované kyseliny sírové
- vznikají sulfoniové kyseliny
- elektrofilním činidlem je $^+SO_2OH$
- Alkylace
- do aromatického kruhu se zavádí alkyl
- provádí se působením halogenalkanů
- elektrofilním činidlem je alkylový kation $R^+$
- Acylace
- je zavedení skupina $-CO-R$ do aromatického kruhu
- provádí se reakcí s acylhalogenidy
- vznikají ketony
Radikálová adice
- Katalytická hydrogenace
- zaníká aromaticita
- Halogenace
- zaniká aromaticita
- vzniká cyklické uhlovodíky
Oxidace
- aromatický kruh přímo neoxiduje
- oxidují postranní řetězce
- vznikají oxoderiváty
Zástupci
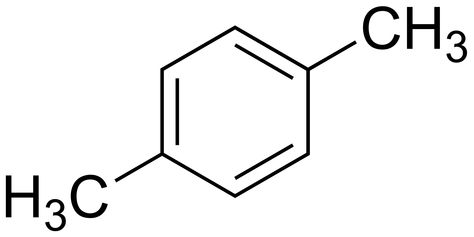
Toluen
- $C_6H_5-CH_3$, methylbenzen
- má podobné vlastnosti jako benzen
- je dobrým orgnanickým rozpouštědlem
- jeho páry mají omamné účinky
- při čichání způsobuje trvalé poškození mozku a jater
- při větším zasažení způsobuje smrt
Styren
- $C_6H_5-CH=CH_2$, vinylbenzen, ethenylbenzen
- je výchozí látkou pří výrobě polystyrenu
- jeho páry jsou karcinogenní a poškuzují kostní dřeň
Naftalen
- $C_{10}H_8$
- tvoří perleťově bílé krystalky
- sublimuje za pokojové teploty
- má desinfekční účinky
- odpuzuje některé živočichy
- používá se k ochraně proti molům
- je základní surovin při výrobě některých barviv k ochraně proti molům
- je základní surovin při výrobě některých barviv ochraně proti molům
- je základní surovin při výrobě některých barviv