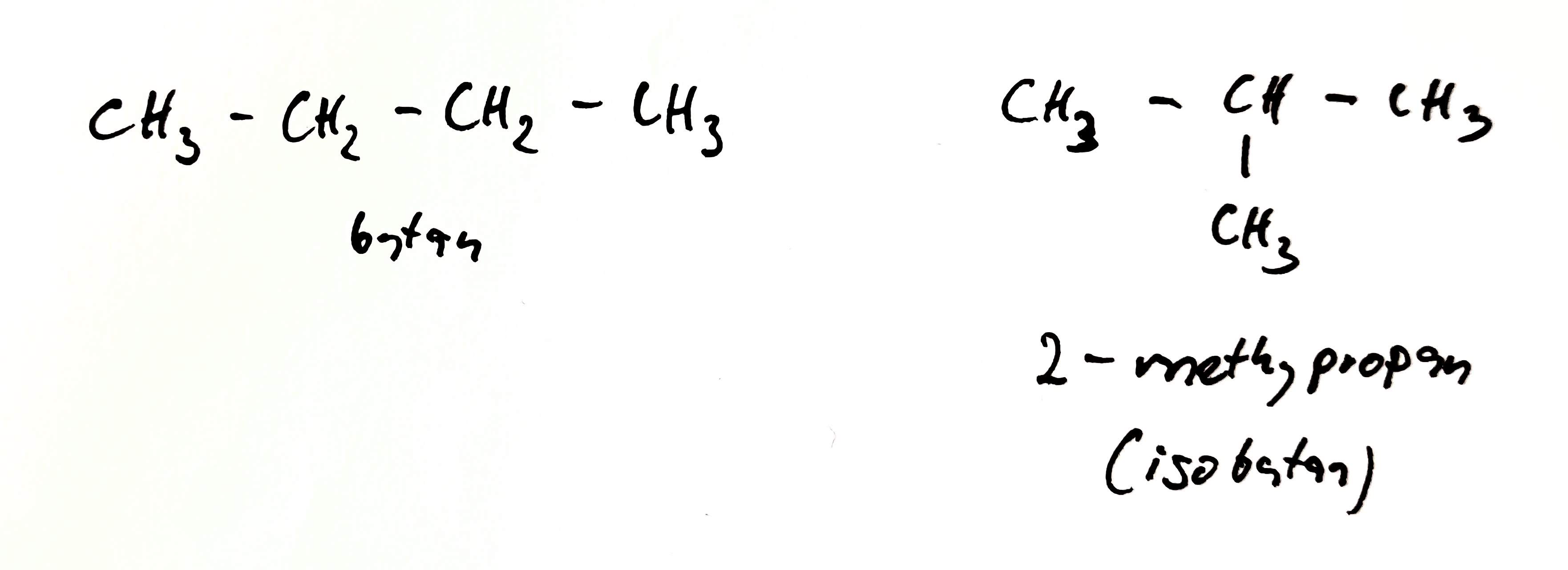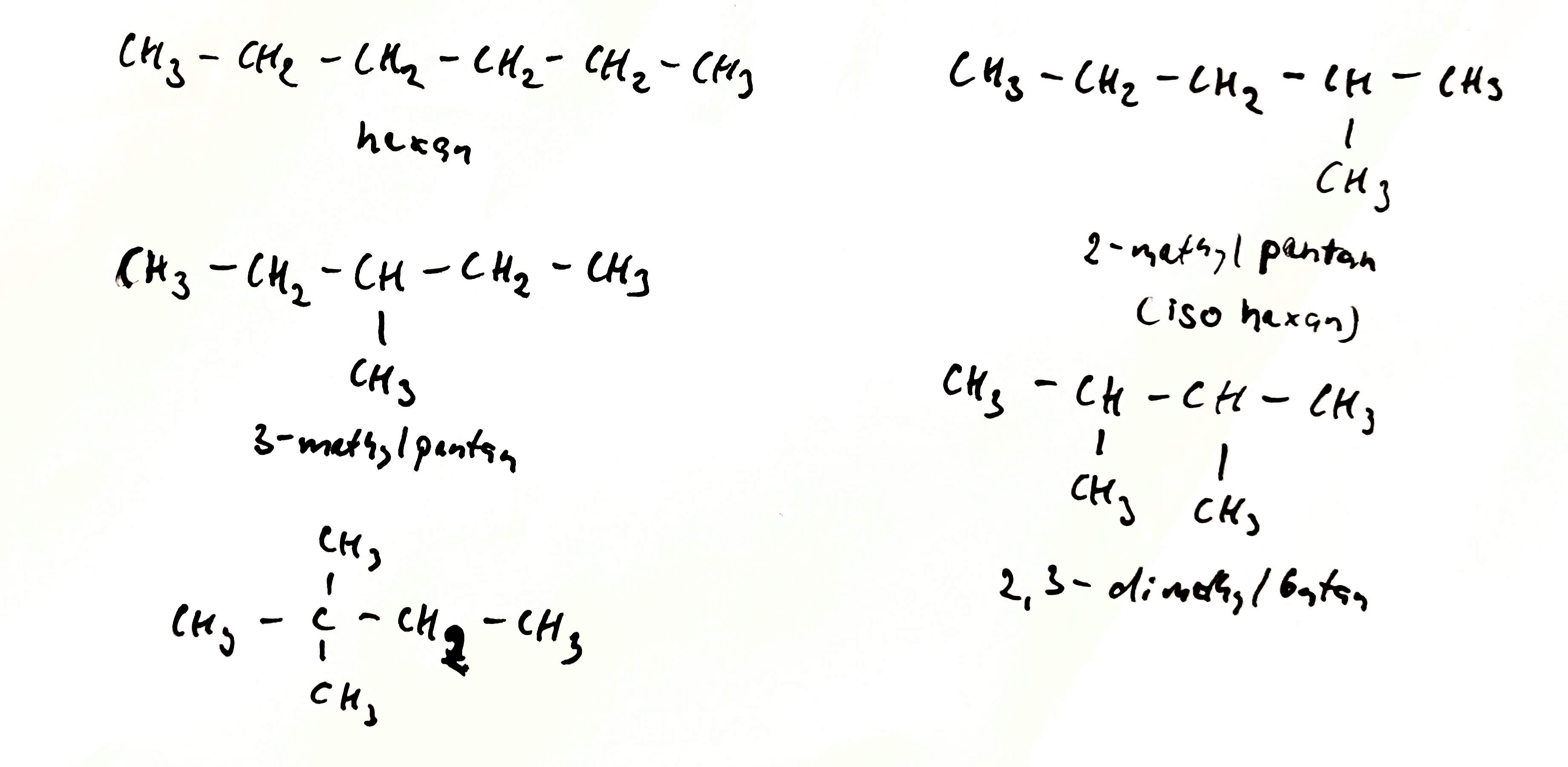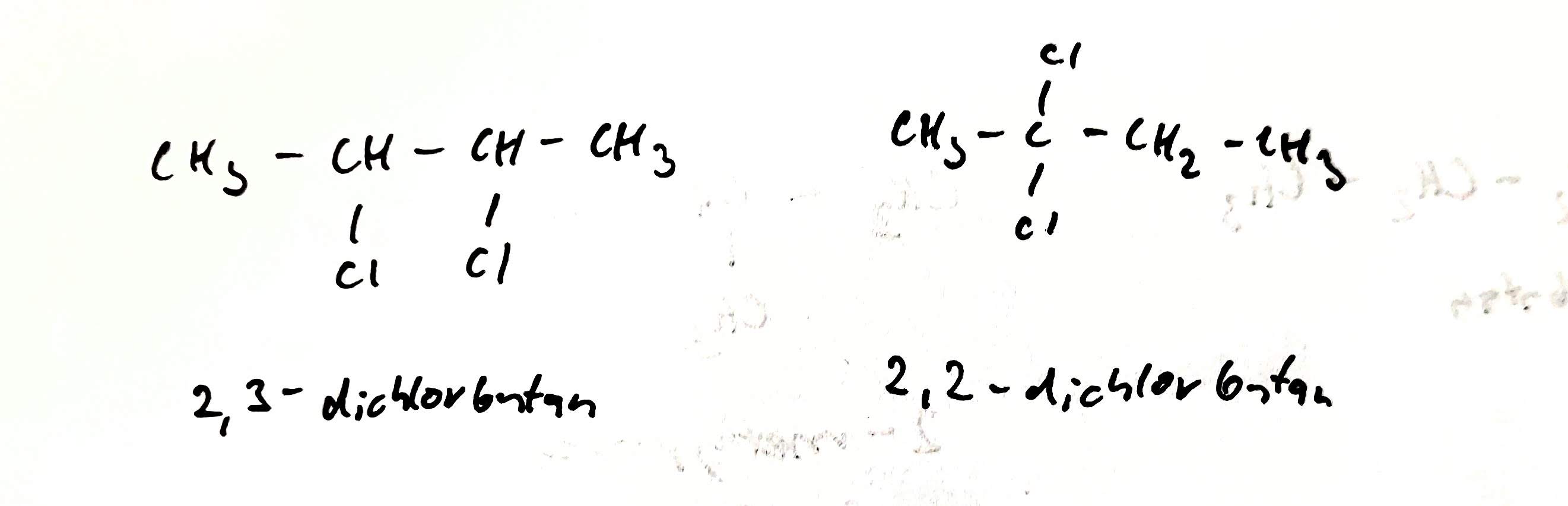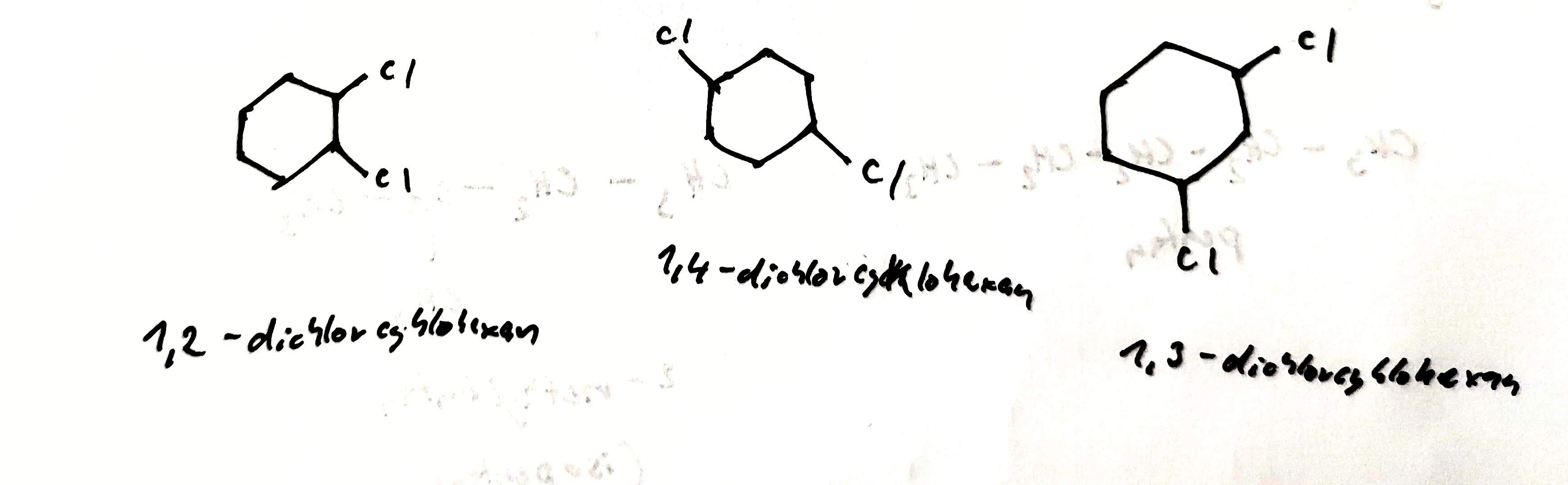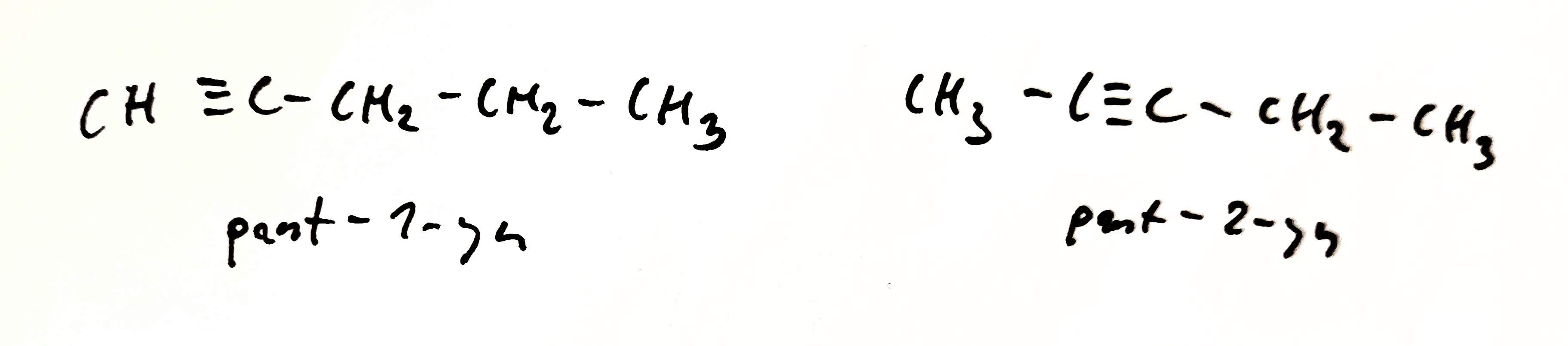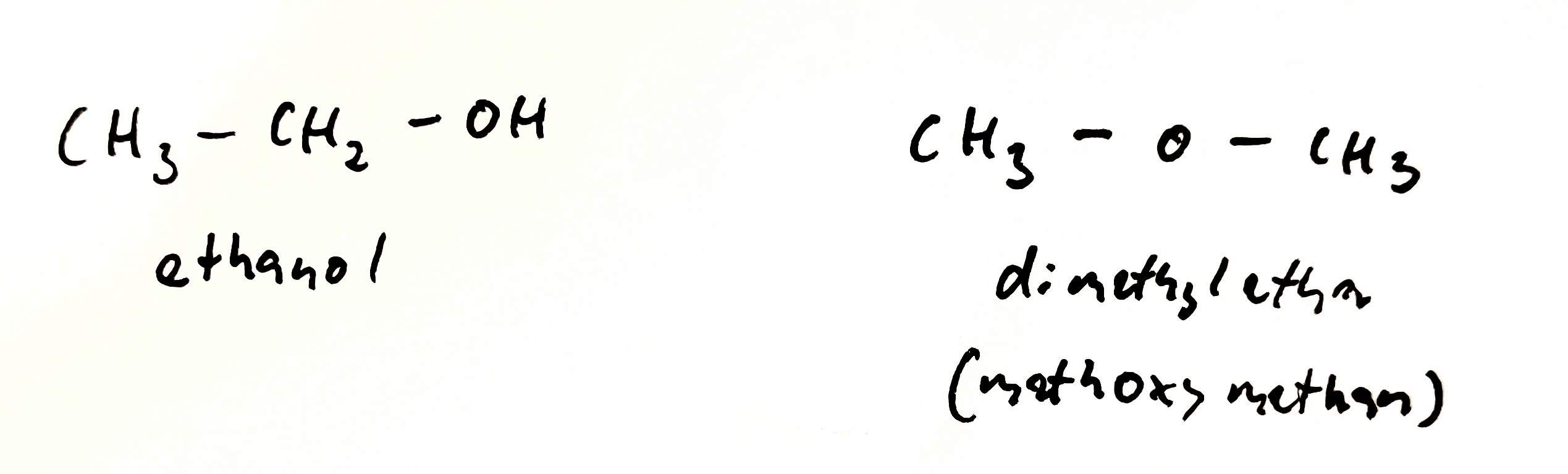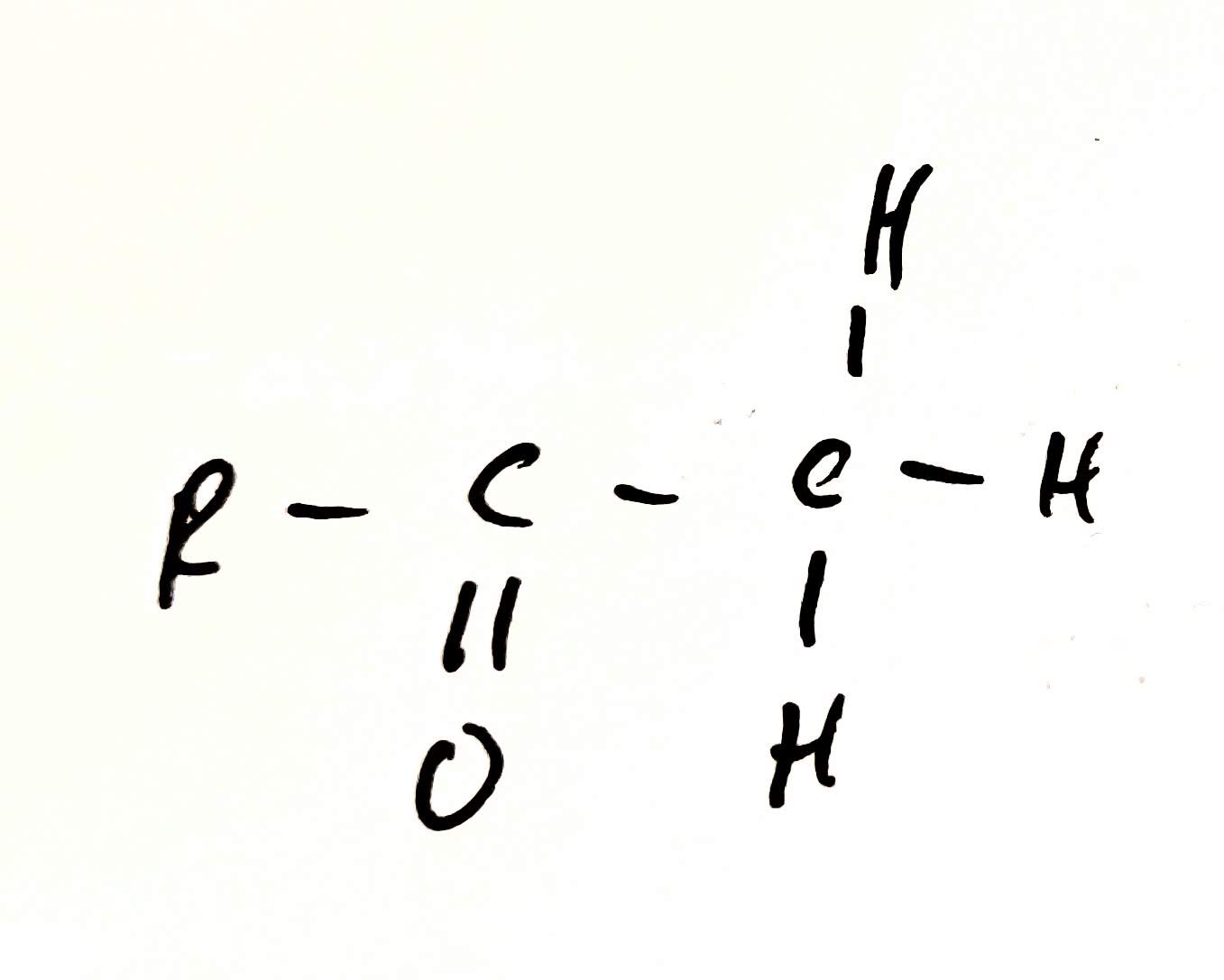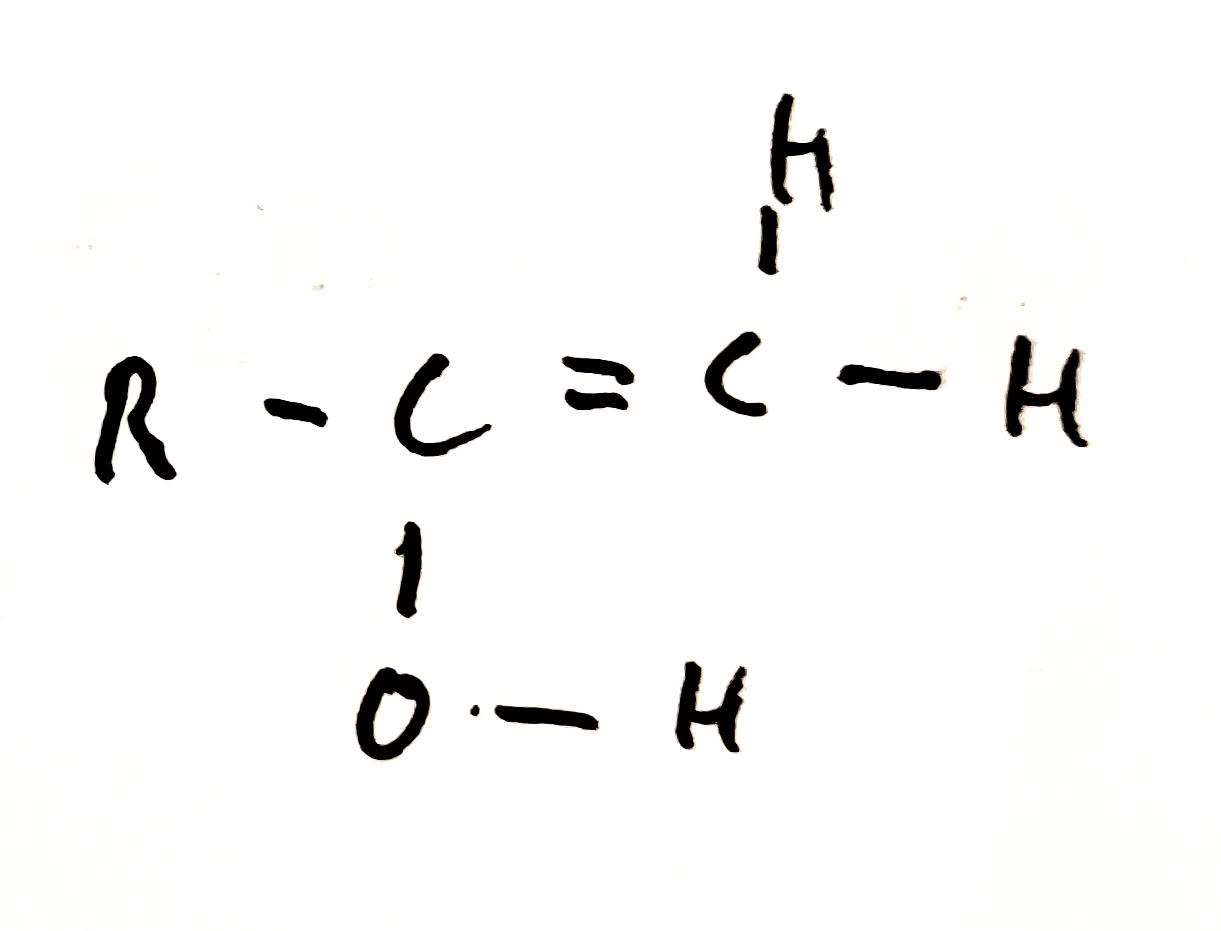- mají stejný sumární vzorec, ale různou strukturu nebo prostorové uspořádání
- různá struktura podmiňuje vlastnosti
Konstituční izomerie
- stejný sumární vzorec, ale jiný strukturní vzorec
- Konstituce
- pořadí atomů
- pořadí a druh vazeb
Řetězcová izomerie
- izomery se liší tvarem řetězce
- izomery patří ke stejné homologické řadě
- týká se jen čistých uhlovodíků
- např.:
Polohová izomerie
- izomery se liší polohou substituentů nebo polohou násobné vazby
- např.:
Skupinová izomerie
- izomery se liší typem funkční vazby
- izomery patří k různým homologickým řadám
- mají velmi různé fyzikální vlastnosti
- Alkohol a ether
- Aldehyd a keton
- Karboxylová kyselina a estery
Tautomerie
- izomery se liší polohou atomu vodíku a dvojné vazby
- izomery mají stejný empirický a molekulový vzorec, ale různý strukturní a racionální vzorec*
- mají stejný uhlíkový řetězec
- obě formy jsou v dynamické rovnováze
- Keto-enol tautomerie
Konfigurační izomerie (stereoizomerie)
- stereoizomery se liší pouze v prostorovém uspořádíní
- mají různý konfigurační vzorec
Geometrická izomerie
- stereoizomery se liší konfigurací substituentů na dvojné vazbě nebo v cyklu
- mají rozdílné fyzikální vlastnosti
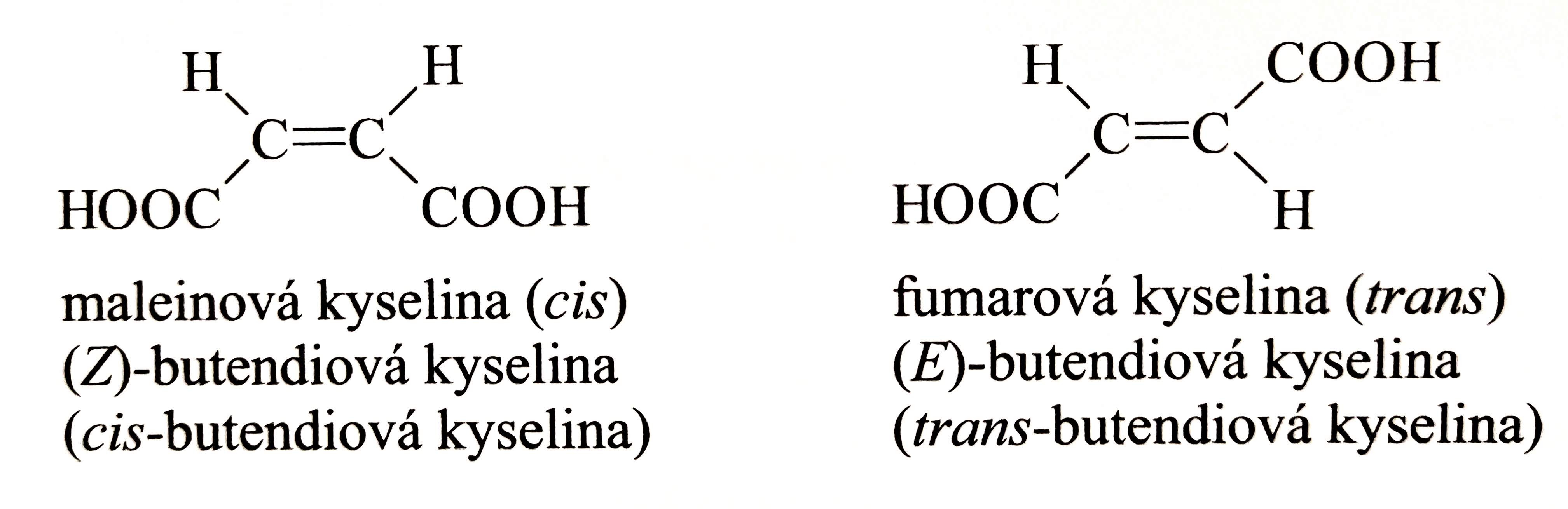
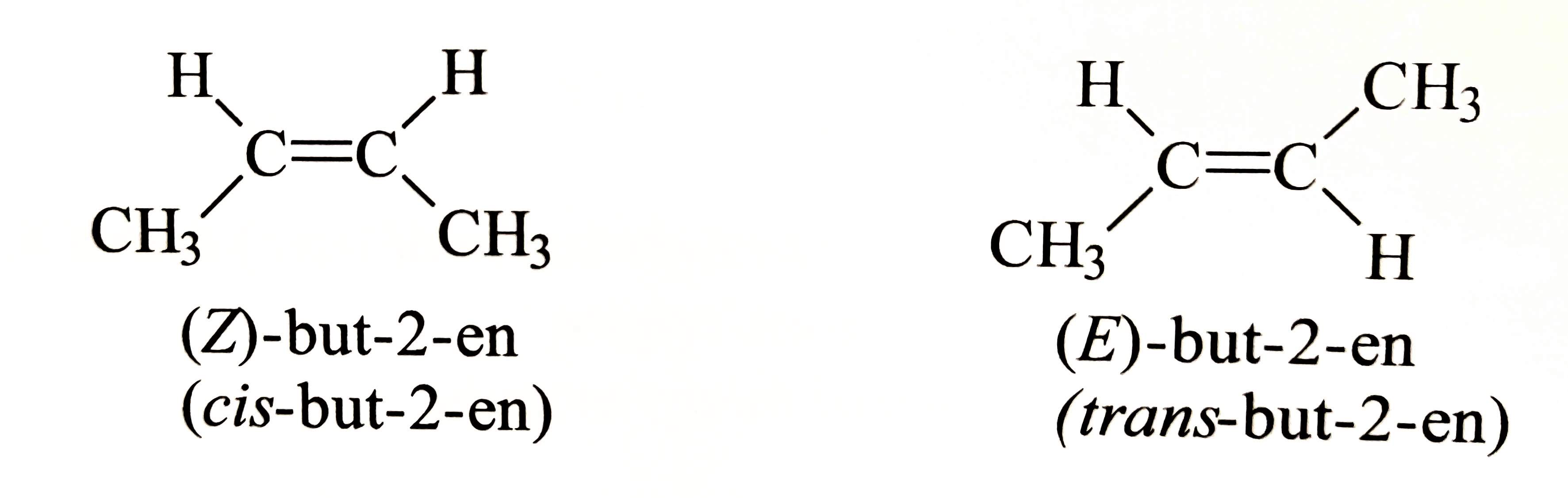
- cis-izomer
- substituenty leží na stejné straně dvojné vazby
- nově se značí Z-izomer
- trans-izomer
- substituenty leží na opačných stranách dvojné vazby
- nově se značí E-izomer
Alkeny
- substituenty nejsou kvůli dvojné vazbě volně otáčivé
- jsou-li na každém uhlíku dvojné vazby vázané substituenty, existují dva stereoizomery cis a trans
- rozhoduje i priorita skupin
- obecně čím vyšší protonové číslo, tím větší priorita
- rozhoduje i priorita skupin
- např.:
Nenasycené karboxylové kyseliny
Cykloalkany
- volná rotace substituentů kolem jednoduché vazby je v cyklu omezena
- subsituenty nad rovinou cyklu nelze otočit pod rovinu
- vznikají dva stereoizomery cis a trans
- např.:
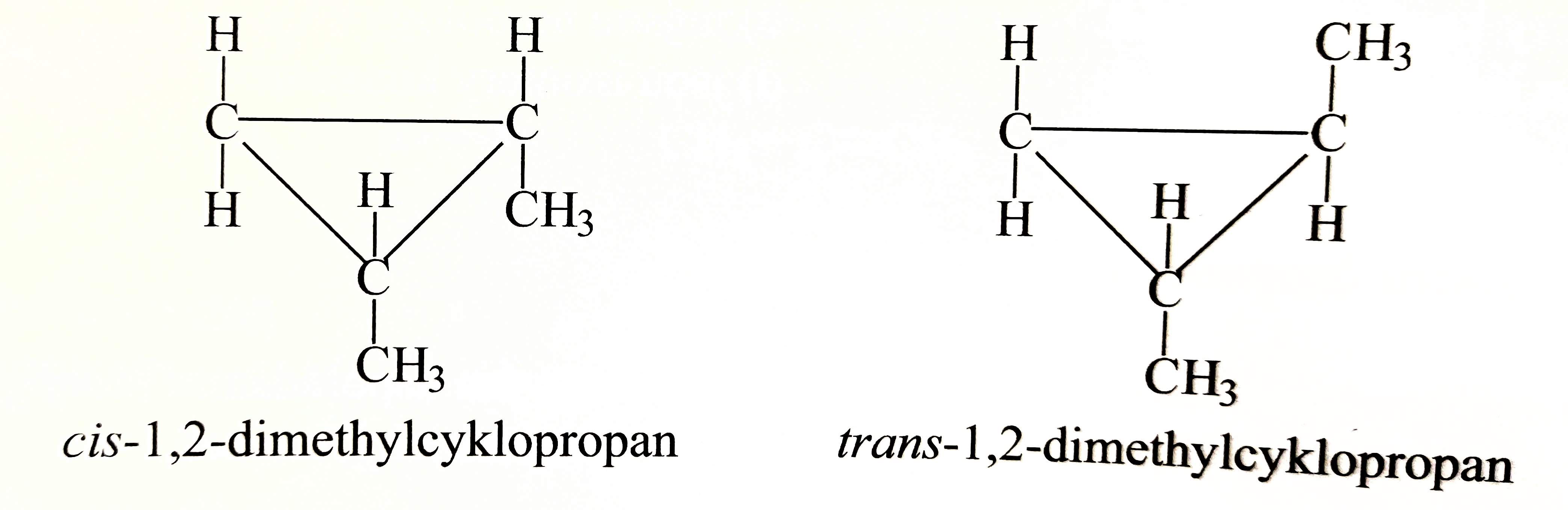
- některé látky jsou schopny otáčet rovinu polarizovaného světla
- tyto látky jsou opticky aktivní
- nemají rovinu ani střed symetrie
- chirální uhlík
- je to takový atom uhlíku, ze kterého vycházejí čtyři různé vazby (včetně $C-H$)
- ve vzorci se označuje $C^{*}$
- vznikají dvě formy
- jsou zrcadlovými obrazy sami sebe
- žádnou geometrickou operací je nelze ztotožnit
- nazýváme je enantiomery
- jejich fyzikální vlastnosti jsou přibližně stejné
- liší se jejich optická aktivita
- mohou se lišit průběhy reakcí s nimi
- jsou zrcadlovými obrazy sami sebe
- Otáčivost
- Racemát (ekvimolární směs)
- směs dvou enantiomerů
- je opticky inaktivní (optické účinky enantiomerů se liší)
- Konfigurace chirálního uhlíku
- používáme označení D- a L-
- nesouvisí se směrem polarizovaného světla
- opticky aktivní látky mohou mít označení ($+$)D-, ($-$)D-, ($+$)L-, ($-$)L-
- Fisherova projekce
- používá se pro znízornění vazeb na chirálním uhlíku
- uhlík č. 1 je položen nejvýše (nahoře v nákresu)
- vertikální vazby chirálního uhlíku směřují dozadu
- značí se čárkovaně
- horizontální vazby chirálního uhlíku směřují dopředu
- značí se klínkem (vyplněným zobáčkem)
- dexter izomer
- funkční skupina na pravé straně
- používáme označení s D-
- laevus izomer
- funkční skupina na levé straně
- používáme označení s L-
- pokud je v molekule více chirálních uhlíků, určujeme podle posledního uhlíku (s nejvyšším lokantem)
- používáme označení D- a L-
- Diastereomery
- stereoizomery, které nejsou vzájemnými enantiomery
- meso-forma
- jsou to izomery s více než jedním chirálním centrem, který má rovinu symetrie
Konformace
- různá prostorová uspořádání molekul stejné sloučeniny
- konformery
- vznikají rotací jednotlivých molekul kolem jednoduché vazby
- liší se potenciální energií
- čím jsou nevazebné interakce slabší, tím je molekula stabilnější
- konformer s nejnižší potenciální energií je nestabilnější
- mezi konformery s ustavuje rovnováha
- při určité teplotě vzniká směs konformerů
- převldá ten s nejstabilnější konformací pro danou teplotu
- při určité teplotě vzniká směs konformerů
- Konformace cyklohexanu
- Konformace ethanu