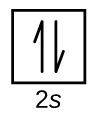Historie atomismu
- John Dalton
- představa atomu jako koule
- hypotéza existence nedělitelných částic, které se liší podle druhu látky

- Joseph J. Thompson
- atom se skládá s kladně nabité hmoty, ve které jsou záporně nabité elektrony

- Ernest Rutherford
- hypotéza, že atom se skládá z kladně nabitého jádra okolo kterého obíhají záporně nabité elektrony
- založená na experimentu se zlatou folií

- Niels Bohr
- elektrony obíhají na určitých vzdálenostech od jádra, které mají různou energii
- elektrony mohou přeskakovat mezi vrstvami po dodání nebo vyzáření energie

- Erwin Schrödinger
- elektrony nemají jasné místo
- Vlnově-částicový dualismus
- některé částice se chovají zároveň jako vlny a zároveň jako partikule
- platí pro elektrony
- Orbital
- místa, kde se s největší pravděpodobností nachází elektrony
Struktura atomu
- atom se skládá z:
- protonů (kladně nabitých částic)
- elektronů (záporně nabitých částic) a
- neutronů (neutrálních částic)
- protony a neutrony v jádře nazýváme nukleony
Protonové (atomové) číslo ($Z$)
- údává počet protonů v atomu
- zapisuje se do levého dolního indexu u symbolu prvku
- $_{11}Na$
- zároveň udává počet elektronů atomu v elektroneurálním stavu
Nukleonové (hmotnostní) číslo ($A$)
- udává počet nukleonů v atomu
- zapisuje se do levého horního indexu u smybolu prvku
- $^{23}Na$
Neutronové číslo ($N$)
- počet neutronů v atomu
- zapisuje se do pravého horního indexu u symbolu atomu, ale většinou se neuvádí
- $Na^{12}$
- v moleukulách a sloučeninách se počty atomů zapisují do pravého dolního indexu
- $UF_6$
Pojmy související s atomy a strukturou atomu
- Izotopy
- mají stejné protonové číslo, ale různé nukleonové číslo
- jednotlivé izotopy pak mají různé fyzikální vlastnosti
- Nuklidy
- mají stejné protonové i nukleonové číslo
- Izobary
- mají stejné nukleonové číslo, ale různé protonové číslo
- Izotony
- mají stejné neutronové číslo, ale různé protonové a nukleonové číslo
- Molekuly
- 2 a více atomů spojených dohromady ($H_2; Cl_2$)
- sloučeniny
- 2 a více různých atomů spojených dohromady ($NH_3; H_2SO_4$)
Stavba elektronového obalu
- elektrony určují vlastnosti atomu (reaktivita, vaznost,…)
Valenční elektrony
- jsou nejdůležitější
- nacházejí se ve valenční vrstvě
- je to vrstva nejdál od jádra
Elektronový strukturní vzorec
- používá se k zápisu valenčních elektronů
- volné elektrony se zapisují pomocí tečky u symbolu prvku (např.: $H \cdot$)
- volné elektronové páry pomocí čárek u symbou prvku (např.: $\overline{\underline{O}}:$)
Kvantová čísla
- slouží k určení přibližné pozice elektronu
Hlavní kvantové číslo ($n$)
- určuje sféru (energetickou vrstvu), na které se elektron nachází
- tím určuje jeho energii $$n\in\mathbb{N}$$
- číslo $1$ odpovída sféře $K$ a další čísla odpovídají písmenům anglické abecedy od písmene $K$
- např.: $n=2$, vrstva $L$
- čim vyšší číslo, tím větší má elektron energii
Vedlejší kvantové číslo ($l$)
- určuje typ (tvar) orbitalu a energii elektronu
$$l\in\mathbb{N}_0;l={0,…,n-1}$$
- např: $n=6$ potom $l={0;1;2;3;4;5}$
- číslo $1$ odpovídá orbitalu typu $s$
- číslo $2$ odpovídá orbitalu typu $p$
- číslo $3$ odpovídá orbitalu typu $d$
- číslo $4$ odpovídá orbitalu typu $f$
- teoreticky existují i další typy orbitalů, ty pak pokračují od písmene $g$ podle anglické abecedy
Magnetické kvantové číslo ($m$)
- určuje prostorovou orientaci orbitalu
- $m\in\mathbb{Z};m={-l,…,0,…,+l}$
- např.: $l=2$ potom $m={-2;-1;0;1;2}$

- orbitaly se stejnou energií (prosotorvé orientace jednoho typu orbitalů) se nazývají degenerované
Spinové kvantové číslo ($s$)
- udává spin elektronu
- má hodnoty $+\frac{1}{2}$ a $-\frac{1}{2}$
Elektronová konfigurace
- způsoby znázornění elektronů a orbitalů:
- Pomocí symbolů
- $nl^x$ kde $n$ je hlavní kvantové číslo, $l$ je vedlejší kvantové číslo (píšeme přímo typ orbitalu) a $x$ je počet elektronů
- např.: na druhé energetické vrstvě jsou v orbitalu $p$ čtyři elektrony -> $2p^4$
- $nl^x$ kde $n$ je hlavní kvantové číslo, $l$ je vedlejší kvantové číslo (píšeme přímo typ orbitalu) a $x$ je počet elektronů
- Graficky
- Pomocí symbolů
Obsazování orbitalů
- pro obsazování orbitalů atomu v základním stavu platí nškolik pravidel
Pauliho princip výlučnosti
V každém orbitalu mohou být maximálně 2 elektrony, které mají opačný spin a tvoří tak elektronový pár
- spin se znázorňuje šípkami ($+\frac{1}{2}$ -> $\uparrow$, $-\frac{1}{2}$ -> $\downarrow$ )
V jednom atomu nemohou existovat 2 elektrony se všemi čtyřmi kvantovými čísly stejnými
- z toho plyne kapacita jednotlivých typů orbitalu
- $s^2$ $p^6$ $d^{10}$ $f^{14}$
Výstavbový princip
Elektrony obsazují atomové orbitali postupně, podle rostoucí energie. Minimální energii ma orbital $1s$

- z tohoto diagramu vyplívá, že orbitali se budou zapisovat v tomto pořadí:
- $1s$ $2s$ $2p$ $3s$ $3p$ $4s$ $3d$ $4p$ $5s$ $4d$ $5p$ $6s$ $4f$ $5d$ $6p$ $7s$ $5f$ $6d$ $7p$
Hundovo pravidlo
Nejprve musí být v každém degenerovaném orbitalu jeden nepárový elektron, teprve potom vzniká elektronový pár
Nepárové elektrony v degenerovaných orbitalech mají stejný spin
Konfigurace prvků v základním stavu
- při konfiguraci v základním stavu dodržujeme všechna výše zmíněná pravidla v plném znění
- např.:
- $_3Li:1s^22s^1$ (toleruje se i $1s2$ $2s1$)
- $_{17}Cl:1s^22s^22p^63s^23p^5$
- lze používat i zkrácenou variantu kdy část konfigurace nahradím značkou předcházejícího vzácného plynu v periodické tabluce (ty totiž budou mít vždy zaplněnou poslední vrstvu)
| Prvek | Atomové číslo | Elektronová konfigurace | Skupina | Perioda |
|---|---|---|---|---|
| Helium | 2 | $1s^2$ | 18 | 1 |
| Neon | 10 | $1s^22s^22p^6$ | 2 | |
| Argon | 18 | $1s^22s^22p^63s^23p^6$ | 3 | |
| Krypton | 36 | $1s^22s^22p^63s^23p^64s^23d^{10}4p^6$ | 4 | |
| Xenon | 54 | $1s^22s^22p^63s^23p^64s^23d^{10}4p^65s^24d^{10}5p^6$ | 5 | |
| Radon | 86 | $1s^22s^22p^63s^23p^64s^23d^{10}4p^65s^24d^{10}5p^66s^24f^{14}5d^{10}6p^6$ | 6 |
- např.:
- $_{22}Ti:[Ar]4s^23d^2$
- $_{17}Cl:[Ne]3s^23p^5$
- počet valenčních elektronů se určí podle počtu elektronů v poslední vrstvě
- např.: $_{22}Ti:[Ar]4s^23d^2$ bude mít 4 valenční elektrony
Konfigurace iontů
- při zápisu elektronové konfigurace iontů dodržuji včechna pravidla pro obsazování orbitalů a zároveň hlídám počet elektronů v iontu
- např.:
- ${24}Cr^{3+}:[Ar]4s^{2}3d^{1}$ (zatímco ${24}Cr:[Ar]4s^{1}3d^{5}$*)
- některé prvky mají nepravidelnou elektronovou konfiguraci
- je to proto, že bylo zjištěno, že plně nebo zpola zaplněné orbitali $d$ ($d^5;d^{10}$) jsou stabilnější a proto se z orbitalů $s$ odebírají elektrony a dávají se do orbitalů $d$
- výjimka platí pro:
- $d^5$: $Cr,Mo$
- $d^{10}:Cu, Ag, Au$
Konfigurace prvků v excitovaném stavu
- excitovaný stav atomu nastává tehdy, kdy se atomu dodá energie
- mění se konfigurace valenční vrstvy kdy valenční elektrony přechátí do orbitalů s vyšší energií se stejným $n$
- excitovaný vztah se zapisuje pomocí hvězdiček v pravém horním indexu ($X^{*}$)