- kovalentní molekuly mají v prostoru určitý tvar
- směr takové vazby určuje spojnice jader vázaných atomů
- úhel, který spolu uzavírají dvě vazby vycházející z jednoho atomu se nazývá vazebný
- prostorové uspořádání vysvětluje teorie hybridizace
- hybridizace = energetické sjednocení různých orbitalů daného atomu
- vznikají nové energeticky stejné orbitaly, jejichž energie a tvar se od původních orbitalů liší
- hybridizace se určuje pouze u atomu, nikoli molekuly, ale vysvětlje její tvar
- pokud mluvíme o hybridizaci, zajímají nás pouze vazby
- násobné vazby pak míří stejným směrem
Hybridizace
- dochází k hybridizaci jednoho orbitalu
- vznikají dva orbitaly
- svírají vazebný úhel 180°
- molekula má pak lineární tvar
- např.:

Hybridizace
- dochází k hybridizaci jednoho orbitalu
- vznikají tři orbitaly
- svírají vazebný úhel 120°
- molekula má pak triagonální (planární) tvar
- např.:
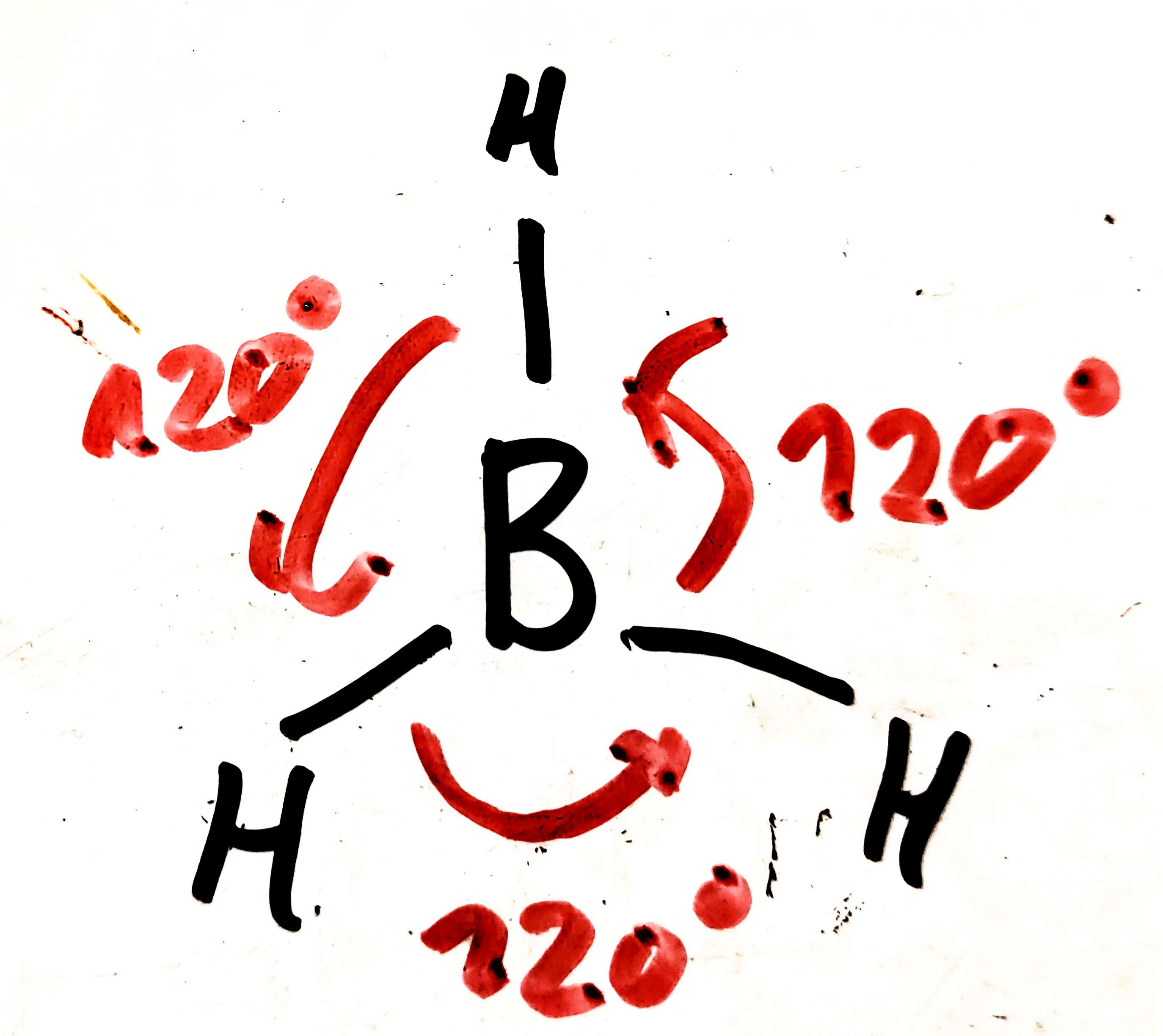
Hybridizace
- dochází k hybridizaci jednoho orbitalu
- vznikají čtyři orbitaly
- svírají vazebný úhel 109.5°
- molekula má pak tetraedrální tvar
- např.:
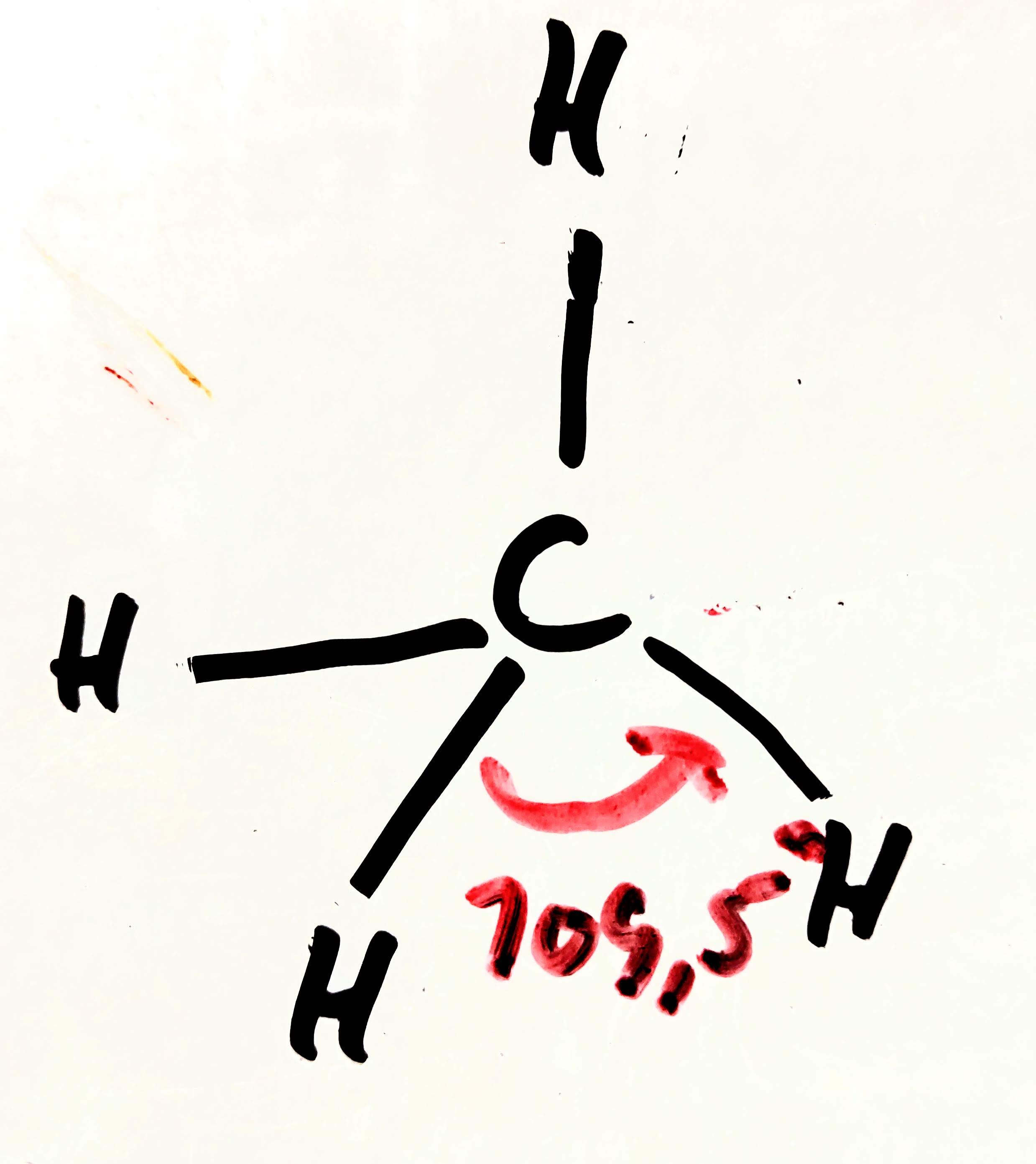
- jestli tvoří atom více než 4 vazby, účastní se jí i elektrony orbitalů
- Hybridizace
- svírají vazebné úhly 120° a 90°
- molekula má pak tvar trigonální bipyramidy
- Hybridizace
- svírají vazebný úhel 90°
- molekula má pak oktaedrální tvar