- je to vědní disciplína, která se zabývá rovnováhami a ději v soustavách obsahujících elektricky nabité částice
Článek, poločlánek, standardní redukční potenciály
- elektrická dvojvrstva
- vzniká na v roztocích soli kovu, ve kterých je ponořen plech daného kovu
- z plechu se uvolňují nebo se do něj dostávají kationty kovu
- způsobí záporný nebo kladný náboj plechu
- plech má opačný náboj než roztok okolo něj
- soustavě, která obsahuje elektrickou dvojvrstvu se říká poločlánek
Článek
- vzniká vodivým propojením dvou poločlánků
- článek tedy tvoří dvě navzájem propojené soustavy
- soustava je tvořena kovem, který je schopen z plechu do roztoku odevzdávat své kationty
- plech je poté záporně nabitý, okolí je kladně nabité
- soustava je tvořena kovem, který je schopen do plechu z roztoku příjmat své kationty
- plech je poté kladně nabitý, okolí je záporně nabité
- tyto dvě soustavy jsou vodivě propojeny solným můstkem
- je to skleněná trubice naplněná elektrolytem, který neraguje s žádným z roztoků
- slouží k přenosu náboje
- trubice je z obou stran ponořená do elektrolytu
- potenciální rozdíl jednotlivých kovů lze určit po připojení voltmetrů
- obecné hodnoty těchto rozdílů získáme při spojení jednoho vždy stejného poločlánku a druhého různého poločlánku (jehož potenciál se snažíme zjistit)
- za srovnávací poločlánek byla zvolena vodíková elektroda
- jedná se o skleněnou trubičku s platinovým plíškem na konci a přívodem vodíkového plynu na druhém
- platinový plíšek je na povrchu pokryt platinovou černí (velmi jemná platina s velkým povrchem), na kterou se atomy vodíku dobře adsorbují
- plíšek je připojen kovovým vodičem do obvodu
- vodíkový poločlánek je poté vytvořen ponořením této konstrukce do roztoku $HCl$ o teplotě 298,15 K a 101,325 kPa
- jedná se o skleněnou trubičku s platinovým plíškem na konci a přívodem vodíkového plynu na druhém
- dohodou bylo ustanoveno, že potenciál vodíkové elektrody je 0
- měřením za standardních podmínek potom výsledkem budou standardní redukční potenciály
- po zapsaní těchto potenciálů můžeme jednotlivé kovy seřadit a vzniká Beketova řada kovů
- pokud je redukční potenciál větší než nula, plech kovu bude kationtu z roztoku příjmat a vice versa
- obdobně lze zjistit i standardní redukční potenciály pro ostatní prvky
- za srovnávací poločlánek byla zvolena vodíková elektroda
Galvanický článek - primární článek
Daniellův článek
- je tvořen poločlánky mědi a zinku v roztocích příslušných síranů spojených solným můstkem
- jeho napětí je 1,1 V
- dnes se už nepoužívá a slouží jen k objasnění základních poznatků elektrochemie
Leclancheův článek - suchý článek
- byl zkonstruován v roce 1866 francouzským inženýrem G. Leclachem
- má široké využití, primárně v jednoduché přenosné technice
- jeho napětí činí 1,5 V
Popis
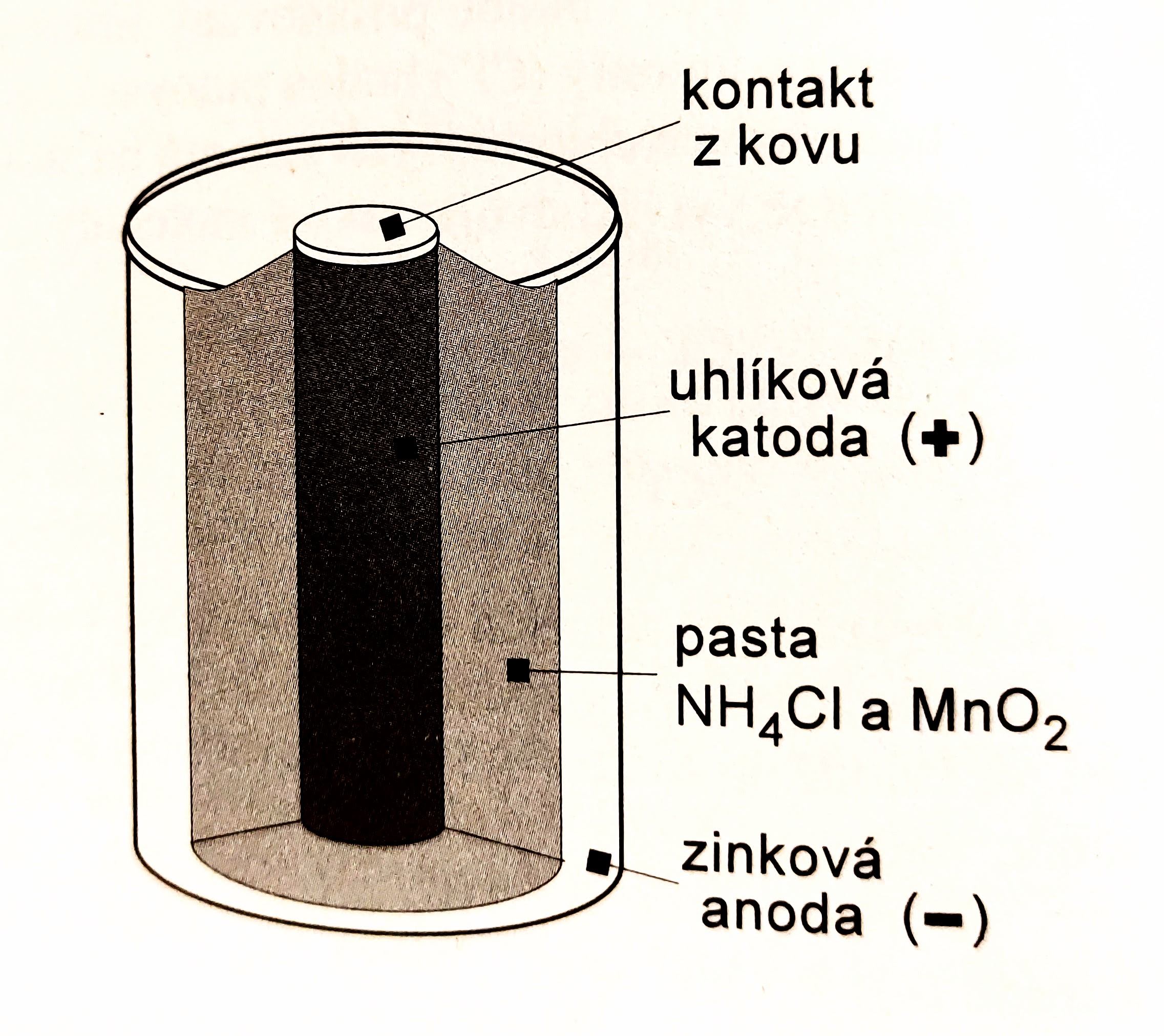
- kladným pólem je uhlíková tyčinka (katoda)
- záporným pólem je zinkový obal (anoda)
- elektrolyt tvoří pasta složená z oxidu manganičitého, chloridu amonného a škrobového mazu
- anoda a katoda mají opačný náboj než při elektrolýze, mají ovšem stejnou funkci
Funkce
- zinek se v kontaktu s elektrolytem oxiduje a vznikají zinečnaté ionty
- kladně nabitý iont vstupuje do reakce se dvěma molekulami chloridem amonným za vzniku komplexu (diammin-dichloridozinečnatý komplex) a dvou molekul vody
- uvolněné elektrony na anodě se poté dostávají do obvodu při zapnutí spotřebiče a na uhlíkové katodě, která se reakce neúčastní redukují oxid manganičitý na oxid hydroxid manganitý
- výsledná reakce může vypadat takto:
$$Zn+2\ NH_4Cl+2\ MnO_2\longrightarrow [Zn(NH_3)_2Cl_2]+2\ MnO(OH)$$
Rtuťový článek
- používá se do naslouchátek nebo hodinek
- má napětí 1,35 V
- má větší životnost než Leclancheův článek
Popis a funkce
- anoda je tvořena amalgamovaným lisovaným zinkovým práškem
- katoda je tvořena směsí oxidu rtuťnatého a grafitu
- jako elektrolyt slouží koncentrovaný roztok hydroxidu draselného
- samotný článek je v obalu z nerezové oceli
- redoxní děje shrnuje rovnice:
$$Zn+HgO\longrightarrow{Hg}+ZnO$$
Akumulátor - sekundární článek
- galvanické články se po jisté době znehodnotí a nelze je dál využít
- oproti tomu existují články, které lze po zapojení ke zdroji energie opět použít
- proud obrátí děje, které probíhají při vybíjení článku
Olověný akumulátor
- je nejpoužívanější
Popis
- základem jsou desky z inertního nosiče (elektrody)
- desky jsou upraveny do mřížek aby měli co největší povrch
- jsou potřeny pastou, kterou tvoří síran olovnatý a kyselina sírová
- desky jsou odděleny separátorem, který zabraňuje jejich kontaktu
- elektrolytem je zředěná kyselina sírová
Funkce
Nabíjení
- připojením ke zdroji stejnosměrného proudu
- na katodě se vylučuje kovové olovo
$$Pb^{II}+2\ e^{-}\longrightarrow{Pb^{0}}$$
- na anodě se vylučuje oxid olovičitý
$$Pb^{II}-2\ e^{-}\longrightarrow{Pb^{IV}}$$
Vybíjení
- nabitou soustavu lze použít jako galvanický článek
- napětí jsou 2 V
- na katodě probíhá redukce oxidu olovičitého
$$Pb^{IV}+2\ e^{-}\longrightarrow{Pb^{II}}$$
- na anodě probíhá oxidace olova
$$Pb^{0}-2\ e^{-}\longrightarrow{Pb^{II}}$$
- děj lze zjednodušit takto:
$$2\ PbSO_{4}+2\ H_{2}O\stackrel{nabíjení}{\underset{vybíjení}{\leftrightharpoons}}Pb+PbO_{2}+2\ H_{2}SO_{4}$$
Nikl-kadmiový akumulátor
- v nenabitém stavu jsou jeho póly tvořeny hydroxidem kademnatým a hydroxidem nikelnatým
- nosič, na kterém jsou oba póly naneseny je vyroben z nerezové oceli
- elektrolytem je hydroxid draselný
- napětí článku je 1,4 V
- děj lze zjednodušit takto:
$$Cd(OH)_2+2\ Ni(OH)_2\stackrel{nabíjení}{\underset{vybíjení}{\leftrightharpoons}}2\ NiO(OH)+Cd+2\ H_2O$$