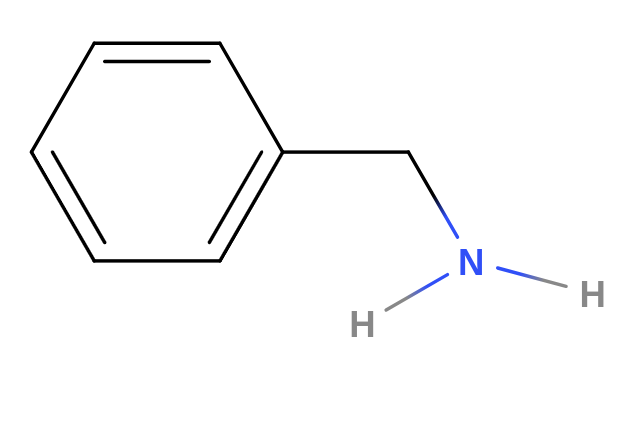
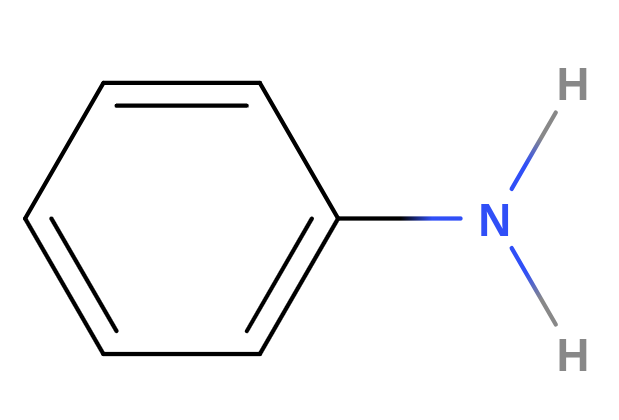
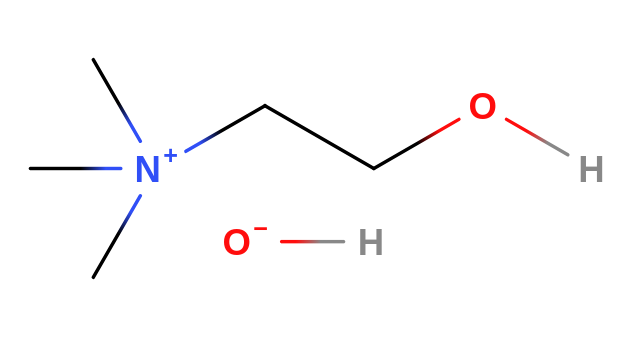
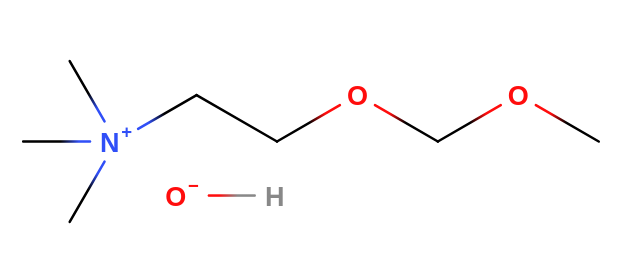
- jsou to organické sloučeniny odvozené od amoniaku
- jeden nebo více atomů vodíku se nahrazuje uhlovodíkovým substituentem
Klasifikace aminů
- primární amin
- jeden atom vodíku je nahrazen uhlovodíkovým substituentem
- $R-NH_2$
- sekundární amin
- dva atomy vodíku jsou nahrazeny uhlovodíkovými substituenty
- $R-NH-R'$
- terciární amin
- tři atomy vodíku jsou nahrazeny uhlovodíkovými substituenty
- $R-N(R’)-R’'$
- alkylamin
- alifatický amin
- arylamin
- aromatické aminy
Nomenklatura aminů
Substituční název
- název se skládá z názvu uhlovodíku a suffixu -amin
- např.:
- $CH_3-NH_2$ - methanamin
- $H_2N-(CH_2)_6-NH_2$ - hexan-1,6-diamin
- tam, kde není aminoskupina hlavní skupinou se označí prefixem amino-
Funkční název
- název se skládá z názvů uhlovodíkových substituentů (podle abecedy) a suffixu -amin
- např.:
- používá se u sekundárních a terciárních aminů
- někdy se jako lokant používá N, což označuje připojení na dusík
- např.:

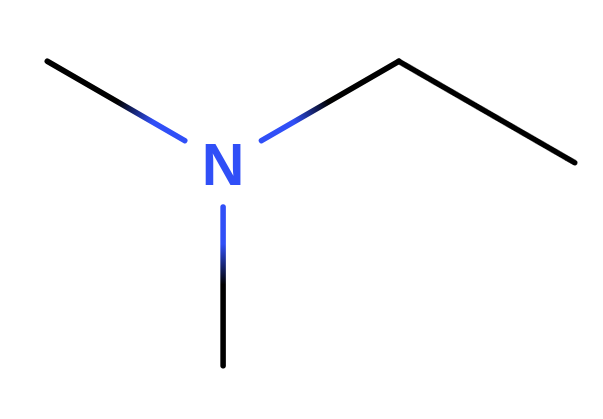
Triviální název
Chemické vlastnosti aminů
- mají bazický charakter
- na dusíku je volný elektronový pár
- alkylaminy jsou silnější než amoniak
- alkyly vykazují +I efekt
- zvyšuje se elektronová hustota na dusíku
- nejsilnější jsou terciární aminy
- arylaminy jsou slabší než amoniak
- aromatický kruh vykazuje +M efekt
Reakce aminů
Neutralizace anorganickou kyselinou
- vznikají alkylamoniové soli
- jsou obdobou amonných solí
- reagují tak všechny typy aminů
- $CH_3CH_2-NH_2+HCl\longrightarrow{CH_3CH_2-NH_3^+Cl^-}$ (ethylamonium-chlorid)
Reakce terciárních aminů s alkylhalogenidy
- vznikají tetraalkylamoniové soli
- výměnou aniontů vznikají tetralkylamonium-hydroxidy
- jsou to velmi silné zásady
- mají velký biologický význam
- např.:
Diazotace
- primární arylaminy reagují s dusitany za vzniku diazoniových solí
- $Ar-NH_2+KNO_2+HCl\longrightarrow{[Ar-N\equiv{N}]^+}$
- jsou to velmi nestabilní látky
- snadno se zahřátím rozkládají
- dají se z nich tvořít barviva (azokupulace)
- reakcí s fenoly
- využívají se v textilním průmyslu
- některé patří mezi acidobazické indikátory
Zástupci
Anilin
- $C_6H_5NH_2$, benzenamin, fenylamin
- je to jedovatá kapalina
- používá se k výrobě barviv, léčiv a plastů
- nalézá uplatnění v organické syntéze
Cholin
- je součástí fosfolipidů lecithinů
Acetylcholin
- je to ester cholinu a kyseliny octové
- v nervovém systému je mediátorem přenosu nervového vzruchu
- způsobuje snížení krevního tlaku, zúžení zornic
- zvyšuje sekreci žláz
- jeho účinek je mnohonásobně větší než cholinu
Aminokyseliny
- jsou základními stavebními jednotkami bílkovin
Alkaloidy
- jsou to složité aminy obsažené v rostlinách
- jsou jedovaté
- mnohé se používají jako léky (morfin)