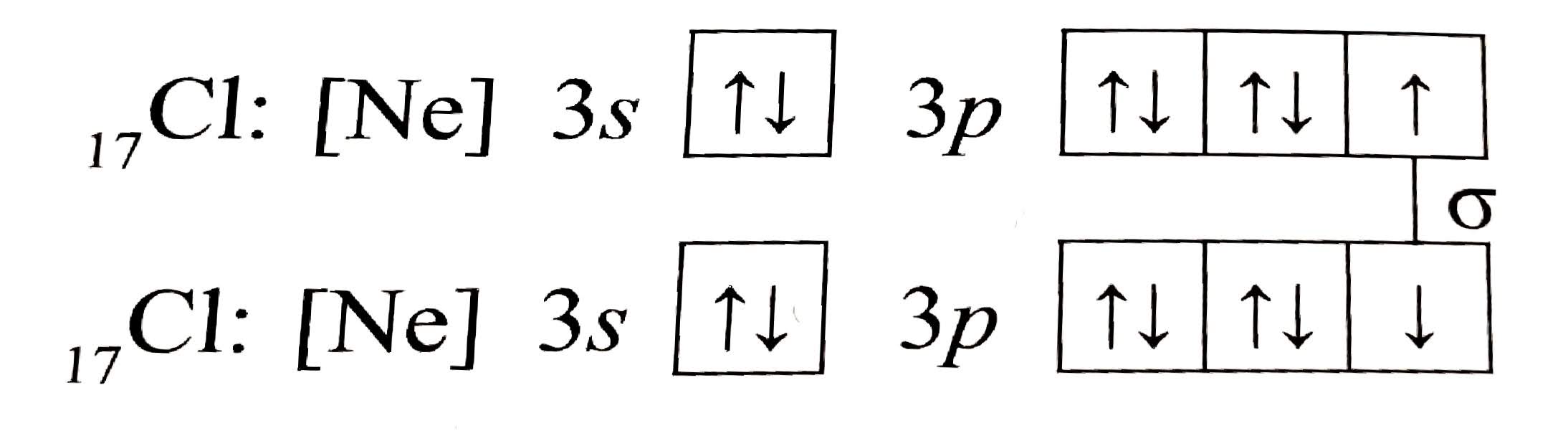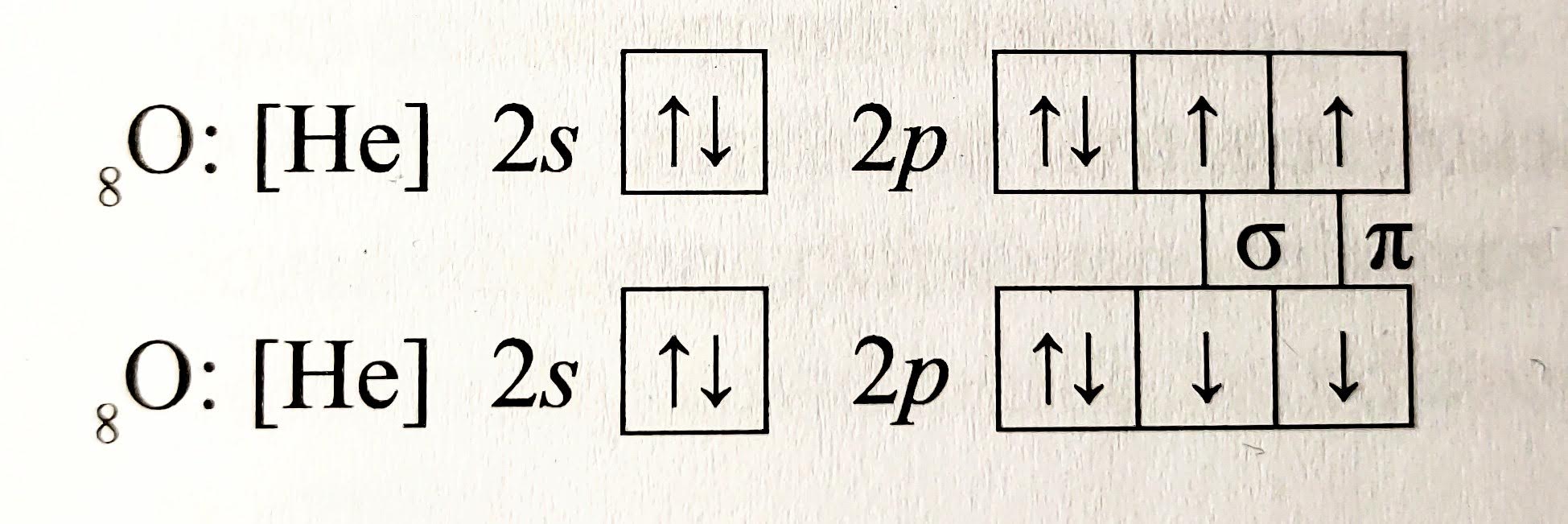Chemická vazba
- chemická vazba je nějaká interakce mezi dvěma a více atomy
- vzniká u atomů s nestabilní elektronovou konfiguraci (1 až 7 valenčních elektronů)
- vzniká takto:
- atomy se k sobě přbližují
- jejich valenční orbitaly se překryjí
- atomy získají stabilnější elektronovou konfiguraci
- vázané atomy mají nižší energii než izolované atomy a proto je vzniklá molekula stabilnější
- při vzniku vazby se uvolňuje energie - vazebná energie
- vazebná energie je stejná energie k rozštěpení této vazby
- velikost vazebné energie charakterizuje pevnost a stabilitu vazby
- při chemických reakcích se atomy snaží dosáhnout elektronového oktetu tedy konfigurace vzácných plynů, čehož lze dosáhnout 2 způsoby:
- sdílením elektronů
- přenosem elektronů
Molekulové orbitaly
- překrytím dvou atomových orbitalů vzniká molekulový orbital
- molekulový orbital je prostor, ve kterém se vazebný elektronový pár vyskytuje s největší pravděpodobností
Molekulový orbital $\sigma$
- vzniká když se atomové orbitaly překrývají na spojnici jader
- vzniká překrytím orbitalů $s-s$ nebo $s-p$ nebo $p-p$
 Různé typy $\sigma$ orbitalů
Různé typy $\sigma$ orbitalů- jelikož jsou elektrony na spojnici jader, elektrony jsou přitahovány oběma jádry současně a vazba je proto silnější
- tvoří vždy jednoduchou vazbu
- např.:
- molekula $Cl_{2}$:
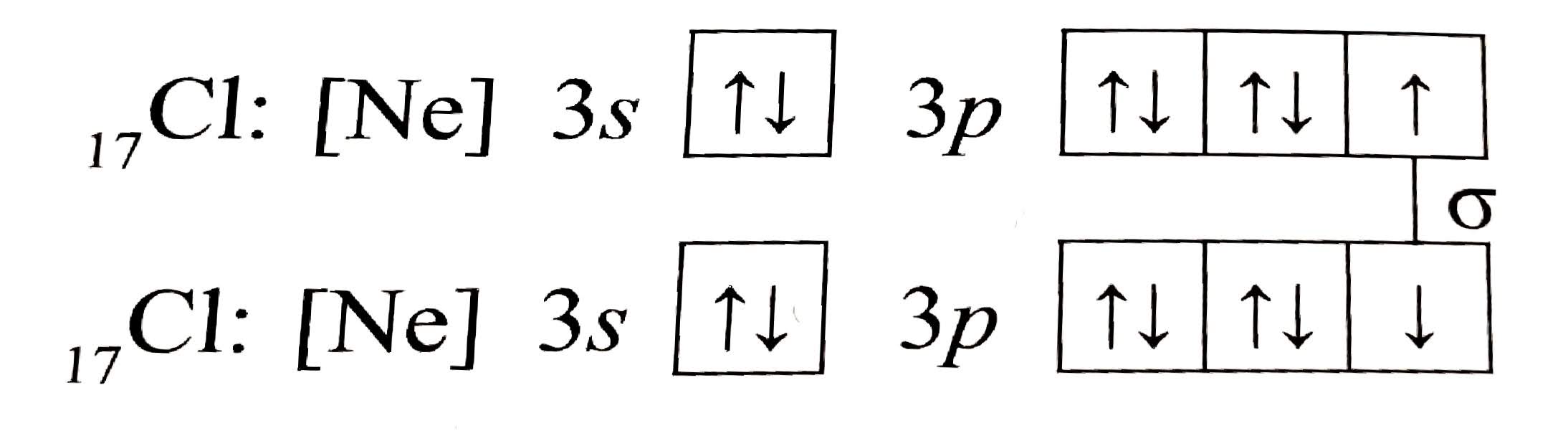 Zázornění vazeb v molekule dichloru
Zázornění vazeb v molekule dichloru - molekula $HCl$:
 Znázornění vazeb v molekule kyseliny chlorovodíkové
Znázornění vazeb v molekule kyseliny chlorovodíkové
Molekulový orbital $\pi$
- vzniká když se atomové orbitaly překrývají mimo spojnici jader
- elektrony vazby se nevyskytují na spojnici jader
- vazba je slabší
- vzniká třeba spojení orbitalů $p_{z}-p_{z}$
- existuje vždy současně s vazbou $\sigma$, tedy jen v molekulách s násobnými vazbami
- např.:
- molekula $O_{2}$ ($\overline{\underline{O}}=\overline{\underline{O}}$)
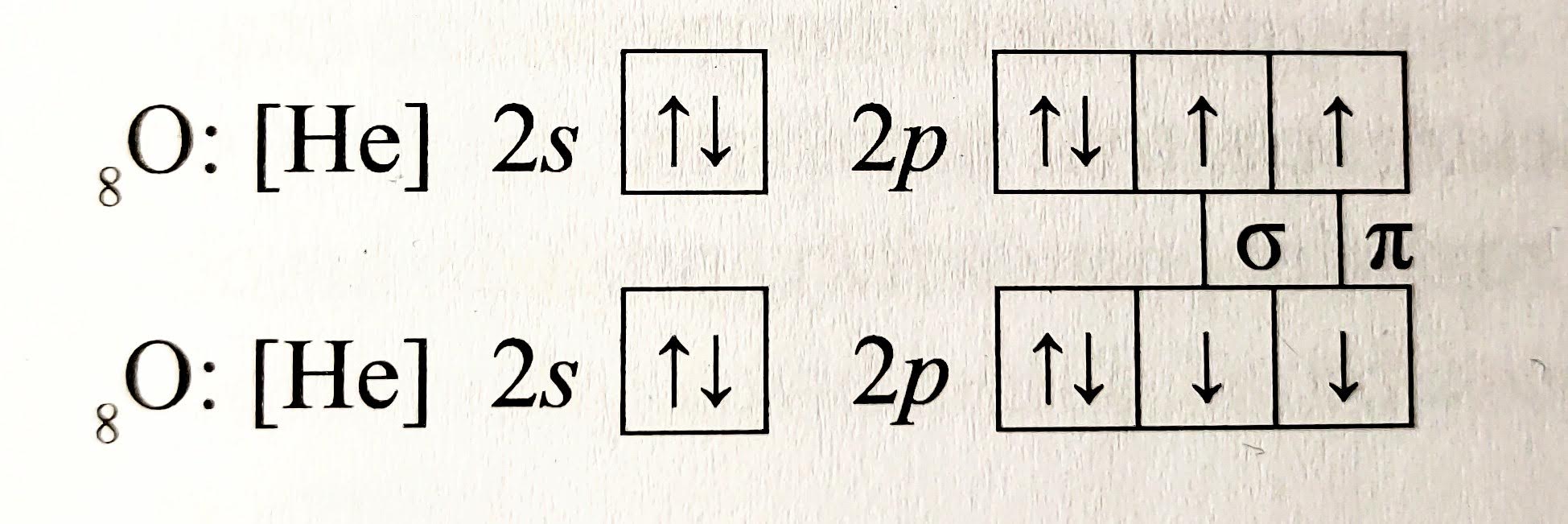 Znázornění vazeb v molekule dikyslíku
Znázornění vazeb v molekule dikyslíku - molekula $N_{2}$ ($|N\equiv N|$)
 Znázornění vazeb v molekule didusíku
Znázornění vazeb v molekule didusíku
Polarita vazeb
- polaritu vazby určujeme podle absolutní hodnoty rozdílu elektronegativit - $|\Delta X|$ (schopnosti atomu přitahovat elektrony) jednotlivých atomů
- čím je rozdíl elektronegativit větší, tím je vazba polárnější
Vazba kovalntní nepolární ($|\Delta X|<0.4$)
- vzniká mezi atomy se stejnou nebo jen velmi málo rozdílnou elektronegativitou
- sdílený pár je mezi účastníky rozložen symetricky
Vazba kovalentní polární ($|\Delta X|\in(0.4,1.7)$)
- vzniká mezi atomy s větším rozdílem elektronegativit
- elektronegativnější účastník vazby přitahuje elektronový pár silněji a je tedy rozložen asymetricky
- na takto vázaných atomech vzniká parciální náboj - $\delta$
- na atomu s menší elektronegativitou je parciální náboj $\delta +$, protože elektrony vazby jsou od něj dál
- na atomu s větší elektronegativitou je parciální náboj $\delta -$, protože elektrony vazby jsou k němu blíž
- molekula má pak kladnou a zápornou stranu a tvoří dipól
Vazba iontová ($|\Delta X|>1.7$)
- rozdíl elektronegativit je tak velký, že dochází k přenosu elektronů mezi atomy
- hranice mezi jednotlivými typy vazeb jsou přibližné a přechod je plynulý
Polarita molekul
- polarita víceatomových molekul závisí na polaritě jednotlivých vazeb a na prstorovém uspořádání
- má velký vliv na další vlastnosti molekuly
- nepolární jsou molekuly, jejichž prostorové uspořádání způsobuje vyrušení dipólů jednotlivých vazeb
- např.: $\text{O=C=O}$
- vektory obou dipólových momentů miří k sobě a vyruší se
- polární jsou molekuly s asymetrickým uspořádáním vazeb a jejich dipóly se tak neruší
- např.: $H_{2}O$
- vektory obou dipólových momentů míří od sebe a výsledný dipól tak míří ve směru výslednice obou dipólů