Bor
- nachází se ve skupině III.A
- jeho elektronová konfigurace je $[He]2s^22p^1$
Zisk a výskyt boru
- bor je poměrně vzácný
- vyskytuje se pouze ve sloučeninách
- nejčastěji boritany a borosilikáty
- vyrábí se elektrolýzou taveniny boritanů
- získává se také metalometricky z $B_2O_3$ pomocí hořčíku
- $B_2O_3+3\ Mg\longrightarrow{2\ B+3\ MgO}$
- takto připravený bor není nikdy zcela čisý a má amorfní povahu
- velmi čistý krystalický bor lze získat redukcí bromidu boritého vodíkem
- reakce probíhá za velmi vysokých teplot
- bor se používá v letecké a raketové technice
- jeho sloučeniny se uplatńují při výrobě chemických skel, porcelánových polev, smaltů a v kosmetice a jako součást pracích prášků
Vlastnosti boru
- diagonálně se podobá křemíku
- je chemicky velmi odolný
- v neoxidujících kyselinách se nerozpouští
- za horka je oxidován kyselinou dusičnou a sírovou
- s roztavenými hydroxidy alkalických kovů reaguje až za vyšších teplot
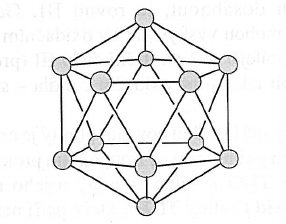
- existuje v několika alotropických modifikacích
- jejich základní strukturní jednotkou je ikosaedr $B_{12}$
Chemické reakce boru
- za laboratorní teploty se přímo slučuje pouze s fluorem
- s kyslíkem přímo reaguje pouze na povrchu
- za vysokých teplot se slučuje s většinou prvků
- přímo nereaguje pouze s vodíkem, germaniem a tellurem a vzácnými plyny
- hořením na vzduchu poskytuje oxid a nitrid boritý
Sloučeniny boru
- oxid boritý $B_2O_3$
- vzniká hořením na vzduchu
- většinou se připravuje žíháním kyseliny borité
- je to bezbarvá, sklovitá látka
- reaguje s vodou za vzniku kyseliny borité
- kyselina boritá $H_3BO_3$
- tvoří bílé šupinkové krystaly
- je to velmi slabá kyselina
- v roztoku se vyskytuje do značné míry nedisociovaná
- při disociaci se chová jako jednosytná kyselina
- $H_3BO_3+2\ H_2O\longrightarrow{[B(OH)_4]^-+H_3O^+}$
- oktahydrát tetrahydoxidotetraboritanu disodného $Na_2[B_4O_5(OH)_4]\cdot{8\ H_2O}$
- borax
- je to jedna z nejvýznamnějších solí kyselin boru
- používá se pro přípravu glazur, smaltů a speciálních optických skel
- halogenidy borité $BX_3$
- jsou to bezbarvé látky
- fluorid a chlorid jsou plyny, bromid je kapalina a jodid je pevná látka
- ve fluoridu boritém $BF_3$ je nejsilnější doposud známá jednoduchý vazba
- boridy $M_nB_m$
- jsou to sloučeniny boru s kovy
- je jich známo přes 200
inou mají nestechiometrické složení v rozmezí $M_5B$ až $MB_{66}$
- atomy boru jsou ve strukuře izolované, v hexagonálním uspořádání, řetězcích a nebo jiných trojdimenzionálních strukturách
- boridy bohaté na kovy jsou velmi tvrdé, inertní a mají vysoké body tání a varu
- některé mají lepší elektrickou vodivost než samotné kovy
- nitrid boritý $BN$
- je to bílá, termicky velmi stálá látka
- nevede elektrický proud
- vzniká reakcí boru s dusíkem nebo amoniakem za vysoké teploty
- také je jedním z produktů hoření boru na vzduchu
- průmyslově se vyrábí tavením kyseliny borité s močovinou v atmosféře vodíku
- existuje ve dvou modifikacích, hexagonální a kubické
- za vysokého tlaku a teploty lze hexagonální modifikaci převést na kubickou modifikaci
- karbid tetraboru $B_{12}C_3$
- je to černá, velmi tvrdá a chemicky odolná látka
- vyrábí se v elektrické peci zahříváním boru nebo oxidu bortého s uhlím
- jeho struktura je tvořena ikosaedry $B_{12}$ a uhlíkovými řetězci
- používá se k výrobě neprustřelných vest a ochraných štítů bojových letadel
- uplatňuje se taky jako materiál na výrobu brzdových a spojkových obloženía jako brusivo
- borany
- mají polymerní strukturu
- jednotky $BH_3$ jsou spojeny elektronově deficitní vazbou
- byla jich připraveny celá řada
- nižší borany jsou kapalné a vyšší pevné
- jsou velmi nereaktivní
- některé jsou na vzduchu samozápalné a tvoří oxid boritý a vodu
- nejjednodušším boranem je diboran $B_2H_6$
