Poznámky
• Chemie • Periodická tabulka • Anorganická chemie • Obecná anorganická chemie • Organická chemie • Obecná organická chemie • Základy společenských věd Ostatní pentely
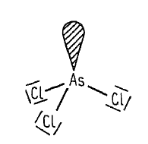
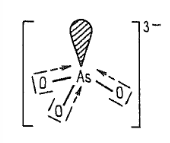
arsen, antimon, bismut nachází se ve skupině V.A konfigurace valenční sféry je $ns^2np^3$ Zisk a výskyt dalších pentelů v zemské kůře jsou poměrně vzácné nejčastěji se vyskytují ve sloučeninách s chalkogeny všechny prvky jsou už dávno známé a dlouho používané Vlastnosti dalších pentelů kovový charakter stoupá s protonovým číslem kovové modifikace jednotlivých prvků mají vrstevnaou strukturu s kovalentními vazbami ve vrstvách a kovové vazby mezi vrstvami Arsen vyskytuje se v několika modifikacíchnejstabilnější je šedý arsen je to kovově šedá, ocelově lesklá, křehká, krystalická látka má vrstevnatou strukturu je silně toxický má vysoký bod tání na vzduchu je nestálý a podléhá samovolné oxidaci Antimon má šest modifikacínestabilnější je šedy antimon je to látka podobná arsenu má také vrstevnatou strukturu je značně toxický Bismut je to křehký, bílý kov s lehkým nádechem do červena svojí strukturou se podobá šedému arsenu jeho krystaly mají velmi charakteristické zbarvení Vazebné možnosti dalších pentelů často se stabilizují na elektronovou osmnáctku nebo dvacítkučím je kov těžší, tím snadněji si zachová inertní elektronový pár jsou u nich reálné oxidační stavy $III$ a $V$ koordinace v jednoduších molekulách je tetraedrická v oxidačním stavu $III$pokud je atom $M^{III}$ koordinován jen třemi vazebnými partnery, vzniká pyramidální strukturajedna z tetraedrických poloh je zaplněna volným elektronovým párem někdy je $\sigma$-vazba doprovázena slabou interakcí $\pi$je vyvolaná překryvem orbitalů $nd$ středového atomu s obsazenými nevyzebnými orbitaly na koordinačnách atomech stejné uspořádání vazeb lze předpokládat v oligo- a polymerních strukturách složených z tetraedrických jednotek v komplexních sloučeninách mají nehčastěji koordinační číslo 4 koordiance ve sloučeninách s oxidačním číslem $V$ je trigonálně bipyramidálnído vazeb se zapojují orbitaly $d$ jiná situace nastává s koordinačním číslem 4čtveřice $\sigma$-vazeb je doprovázena delokalizovanou $\pi$ interakcí s nevazebnými elektronovými páry ligandů příkladem je anion arseničnanový $AsO_4^{3-}$ typické jsou vazby kov-kov a poměrně silné vazby kov-uhlíkvzniká tak mnoho organokovových sloučeninmají různé řetězce, v nichž se atomy kovů střídají s jinými prvky a mimoto jsou přítomny vazby kov-kov kovy mají v takových sloučeninách formálně oxidační stavy, které se vymykají pravidlůmvětšinou se jedná o stav $II$ je to třeba ve sloučeninách $As_4S_4$ nebo $As_4S_3$ s některými vysoce elektropozitivními prvky tvoří sloučeniny v záporném oxidačním stavu $-III$ Reakce dalších pentelů jsou to relativně ušlechtilé prvky jsou odolné vůči působení zředěných kyselin, zásad i voděv roztocích alkalických hydroxidů se za přítomnosti vhodných oxidovadel rozpouštějí$2\ As+5\ NaClO+6\ NaOH\longrightarrow{5\ NaCl+2\ Na_3AsO_4+3\ H_2O}$ v oxidujících kyselinách se za horka rozpouštějí$3\ As+5\ HNO_3+2\ H_2O\longrightarrow{3\ H_3AsO_4+5\ NO}$ $2\ As+3\ H_2SO_4\longrightarrow{3\ H_3AsO_3+3\ SO_2}$ $3x\ Sb+4x\ HNO_3\longrightarrow{3\ (SbO_2)_x+4x\ NO+2x\ H_2O}$ $2\ Sb+6\ H_2SO_4\longrightarrow{Sb_2(SO_4)_3+3\ SO_2+6\ H_2O}$ $Bi+4\ HNO_3\longrightarrow{Bi(NO_3)_3+NO+2\ H_2O}$ $2\ Bi+6\ H_2SO_4\longrightarrow{Bi_2(SO_4)_3+3\ SO_2+6\ H_2O}$ s kyslíkem reagují za vzniku oxidů typu $M_4O_6$mají tedy dimerní strukturuu bismutu to není příliš typickétvoří oxid bismutitý $Bi_2O_3$ se sírou poskytují sulfidy typu $M_2S_3$ s halogeny poskytují halogenidy typu $MX_3$ Sloučeniny dalších pentelů dusičnan-oxid bismutitý $BiNO_3(O)$používá se v kožním lěkařství je součástí Nylanderova činidla používá se k důkazu glukózy k moči Hydridy $MH_3$ stabilita klesá s rosoucím protonovým číslem arsan $AsH_3$připravuje se rozkladem arsenidů vodou nebo zředěnými kyselinami není termicky stabilní a při zahřívání se rozpadáMarshova zkouška slouží k důkazu arsenu sloučeniny arsenu se redukují nascentním vodíkemje to vodík, který má nejasný molekulový vzorecteorie říká, že jsou to nemolekulové vodíky, které vznikají okamžitě po uvolnění ze soustavy, před tím, než se dokážou vázat do dvouatomových molekul $H_2$značí se $H_{\text{nasc.}}$ uvolňuje se arsan je to silné redukční činidlo je prudce jedovatý stiban $SbH_3$ a bismutan $BiH_3$ mají vlastnosti podobnéHalogenidy $MX_3$ a $MX_5$ vzniají přímou syntézou halogenidy $MX_3$ arsenu a antimonu snadno hydrolizují ve vodě$BiX_3$ halogenidy jsou proti hydrolýze odolnější v $AsX_3$ a $SbX_3$ pozorujeme kovlanetní vazbumají v pevném stavu vrstevnatou strukturu v plyném stavu mají molekuly tvar trigonální pyramidy ve vodě hydrolyzují takto:$MX_3+2\ H_2O\longrightarrow{2\ HX+AsOX+H_2O}\longrightarrow{3\ HX+H_3AsO_3}$ halogenidy $MX_5$ byli pozorovány jen ve formě fluoridůjsou velmi reaktivní fluorid bismitičný $BiF_5$ reaguje s vodou explozivněfluorid antimoničný $SbF_5$ se používá k fluorování organický látek Oxidy $M_2O_3$, $M_4O_6$ a $M_2O_5$ oxid arsenitý $As_4O_6$ a antimonitý $Sb_4O_6$vznikají hořením na vzduchu základem jejich struktury je tetraedr atomů prvků, které jsou spojeny kyslíkovými můstky jsou to nejstarší známe jedy oxid bismutitý $Bi_2O_3$připravuje se termickým rozkladem dusičnanů nemá kyselé vlastnosti používá se ve sklářství k výrobě optických skel s velkým indexem lomu oxid arseničný $As_2O_5$s vodou reaguje za vzniku kyseliny arseničné oxid antimoničný $Sb_2O_5$ je ve vodě nerozpustný a oxid busmutičný $Bi_2O_5$ nebyl v čisté formě dosud připravenSulfidy sulfid antimoničný $Sb_2S_5$používá se k vulkanizaci kaučuku sulfid antimonitý $Sb_2S_3$používá se ve sklářství a na výrobu zápalek Kyseliny kyselina (trihydrogen)arsenitá $H_3AsO_3$existuje pouze ve vodných roztocích je to velmi slabá kyselina její alkalické soli jsou rozpustné ve vodě kyselina (trihydrogen)arseničná $H_3AsO_4$podobá se kyselině fosforečné její soli také používá se k deratizaci kyselina antimonitá není příliš známa a je špatně definována její soli obdobně Insekticidy arsenitan vápenatý $CaAsO_2$arsenitan trisodný $Na_3AsO_3$svinibrodská zeleň $3Cu(AsO_2)_2\cdot{Cu(CH_3COO)_2}$diarseničnan-dihydroxid vápenatý $Ca_3(AsO_4)\cdot{Ca(OH)_2}$arseničnan trisodný $Na_3AsO_4$arseničnan olovnatý $Pb_3(AsO_4)_2$