Alkany a cykloalkany
- Alkany
- jsou to nasycené alifatické uhlovodíky
- Cykloalkany
- jsou to nasycené uhlovodíky s obecným vzorcem $C_nH_{2n}$
- jsou izomerní s alkeny
Dělení alkanů podle typu řetězce
- nerozvětvené (přímé) alkany
- rozvětvené alkany
- obsahuje postranní řetězce
- Uhlíkové atomy
- primární uhlíkový atom
- jeden atom uhlíku má na sobě tři atomy vodíku a jeden atom uhlíku
- může být součástí nerozvětvených i rozvětvených alkanů
- sekundární uhlíkový atom
- jeden atom uhlíku má na sobě dva atomy vodíku a dva atomy uhlíku
- může být součástí nerozvětvených i rozvětvených alkanů
- terciární uhlíkový atom
- jeden atom uhlíku má na sobě jeden atom vodíku a tři atomy uhlíku
- je součástí rozvětvených alkanů
- kvartérní uhlíkový atom
- jeden atom uhlíku má na sobě čtyři atomy uhlíku
- je součástí rozvětvených alkanů
Nomenklatura
Nomeklatura alkanů
Alkany s nerozvětveným řetězcem
Alkany s rozvětveným řetězcem
Tvorba názvu
- určime nejdelší řetězec
- např.:

- hlavní řetězec očíslujeme
- polohy alkylů musí mít co nejmenší lokant
- např.:
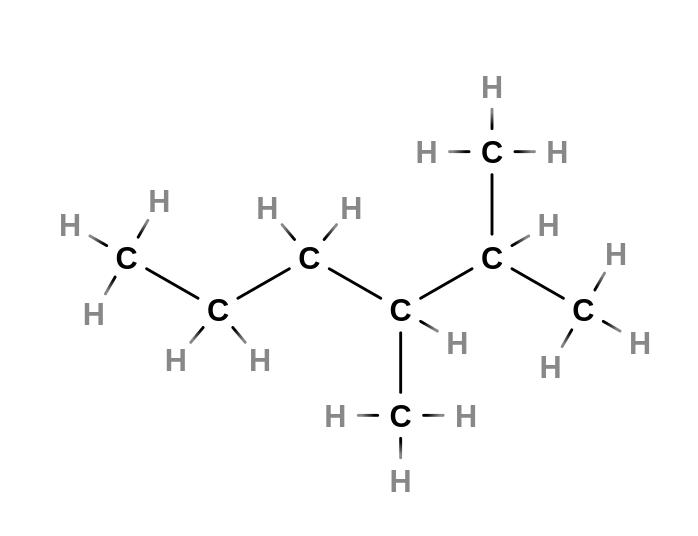
- sestavíme název
- lokant a název substituentu
- mezi lokanty se píše čárka
- mezi lokanty a názvy substituentů se píše spojovník
- substituenty řadíme podle abecedy
- pro více stejných substituentů používáme násobné předpony
- nemají vliv na abecední pořadí
- pokud jsou dva různé substituenty v symetrickém pořadí, ten, který je dřív v abecedě má nižší lokant
- název hlavního řetězce
- např.:
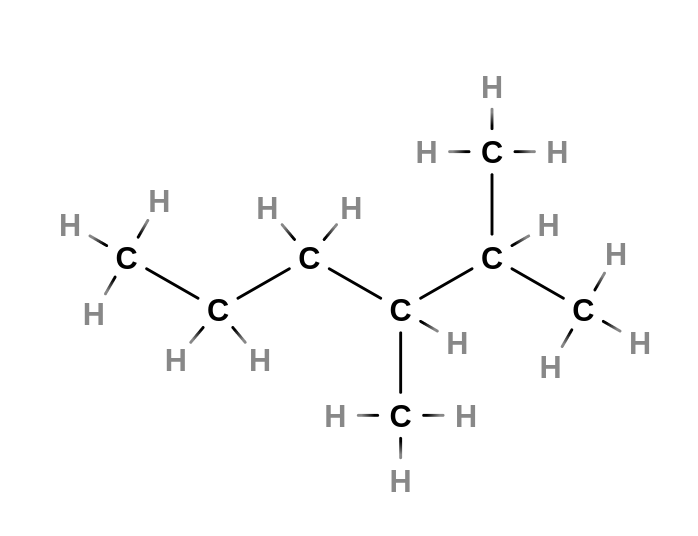
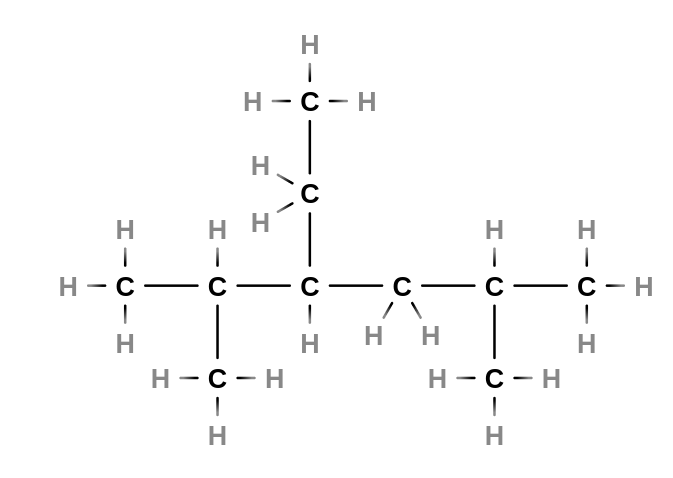
Tvorba vzorce
- napíšeme hlavní řetězec a očíslujeme
- např.: 3-ethyl-2,5-dimethylhexan
- na příslušné uhlíky připojíme substituenty
- např.: 3-ethyl-2,5-dimethylhexan

- doplníme atomy vodíku tak, aby z každého uhlíku vycházeli čtyři vazby
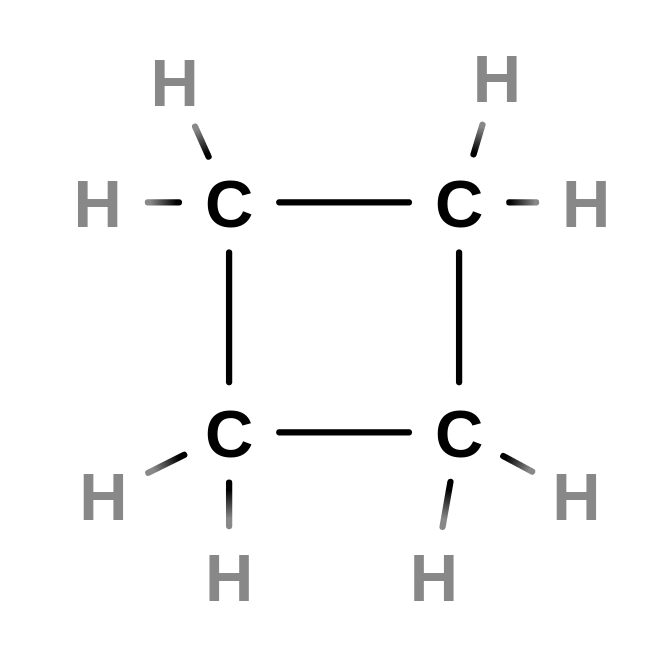
Nomenklatura cykloalkanů
- název se tvoří pomocí prefixu cyklo- k názvu jednoduchého uhlovodíku
- cyklus se čísluje stejně jako řetězce*
- cylkus je vždy hlavní řetězec
- vzorce jsou zacyklené
- např.:
- většinou ce kreslí zjednodučeně
- např.:

Fyzikální vlastnosti alkanů a cykloalkanů
- nižší alkany jsou plyny ($C_1-C_4$)
- jsou hořlavé
- se vzduchem tvoří výbušnou směs
- střední alkany jsou kapaliny ($C_5-C_{15}$)
- vyšší alkany jsou pevné látky ($C_{16}-$)
- Teplota tání a varu
- je relativně nízká
- způsobeno slabšími nevazebnými interakcemi
- body varu rostou v závislosti na počtu uhlíkových atomů v molekule
- alkany s rozvětveným řetězcem mají nižší teplotu tání a varu
- cykloalkany mají nejvyšší body tání a varu
- jsou nepolární
- nejsou rozpustné ve vodě, ale jsou rozpustné v organických rozpouštědlech
- Spalné teplo
- spalné teplo methanu je $890\ kJ\cdot{mol^{-1}}$
- u každého dalšího členu homologické řady se liší o $690\ kJ\cdot{mol^{-1}}$
- Vlastnosti cyklalkanů
- cyklopropan a cyklobutan jsou rektivnější
- jejich vazebné úhly se totiž liší od teoretické hodnoty 109°
- důsledkem je velké pnutí a vyšší reaktivita
- vyšší cykloalkany nemají všechny atomy uhlíku v jedné rovině a vazebné úhly se nedeformují
- otáčivost jednoduchách vazeb je omezena
- vznikají cis a trans izomerií*
Chemické vlastnosti alkanů a cykloalkanů
- jsou málo reaktivní
- obsahují pouze $\sigma$ vazby
- všechny atomy uhlíku mají hybridizaci $sp^3$
- při reakcích se štěpí homoliticky
- typická je radikálová substituce
- podmínkou je dodání energie
- radikály mohou reagovat s neutrálními molekulami za vzniku komplexnějších radikálů
- Stabilita radikálů
- nejstabilnější je methylový radikál ($CH_3\cdot$)
- nejméně stabilní je terciární radikál
- nepárový elektron na terciárním uhlíku
Reakce alkanů
Substituční reakce
Radikálová substituce
Fáze radikálové substituce
- příkladem je halogenace
- v praxi dochází ke vzniku i více chlorovaných uhlovodíků
- $CH_4+Cl_2\longrightarrow{HCl+CH_3Cl}$
- $CH_3Cl+Cl_2\longrightarrow{HCl+CH_2Cl_2}$
- $CH_2Cl_2+Cl_2\longrightarrow{HCl+ CHCl_3}$
- $CHCl_3+Cl_2\ \ \longrightarrow{HCl+CCl_4}$
- vzniká směs všech těchto produktů
- iniciace
- vznik radikálů z molekul halogenu (činidla)
- $Cl_2\stackrel{UV}{\longrightarrow}2\ Cl\cdot$
- propagace
- vznikají alkylové radikály a halogenovodíky
- alkylové radikály napadají molekuly halogenu
- vzniká alkylhalogenid a radikál halogenu, který reaguje znovu s dalšími molekulami alkanu
- probíhá tak dlohou, dokud ve směsi nezbydou další radikály
- $Cl\cdot+CH_4\ \ \longrightarrow{HCl}+CH_3\cdot$
- $CH_3\cdot+Cl_2\longrightarrow{CH_3Cl}+Cl\cdot$
- terminace
- zánik radikálů
- Způsoby zániku radikálů
- na alkylovém radikálu proběhne eliminační reakce
- vzniká nenasycený uhlovodík a vodíkový radikál
- do směsi se přidá inhibitor
- většinou kyslík
- vzniká peroxoalkylový radikál, který je málo reaktivní a zastaví propagaci
- sloučení dvou stejných radikálů
- $2\ Cl\cdot\longrightarrow{Cl_2}$
- $2\ CH_3\cdot\longrightarrow{CH_3CH_3}$
- $Cl\cdot+CH_3\cdot\longrightarrow{CH_3Cl}$
- ukončení halogenace
Nitrace
- probíhá při teplotách 400 - 500 °C
- vodík se nahrazuje nitroskupinou ($-NO_2$)
- používají se oxidy dusíku nebo kyselina dusičná
- reakci iniciuje oxid dusičitý, který ná nepárový elektron ($\cdot{NO_2}$)
- oxid dusičitý může díky nepárovému elektrony tvořit dimer $N_2O_4$
- za standardních podmínek je mezi monomerem a dimerem dynamická rovnováha
- vyšší teplota posouvá rovnováhu ve prospěch monomeru
- propagační reakce:
- $RH+\cdot{NO_2}\longrightarrow{R\cdot}+HNO_2$
- kyselina dusitá je nestabilní
- rozkládá se za vzniku kyseliny dusičné, oxidu dusnatého a vody
- $3\ HNO_2\longrightarrow{HNO_3}+2\ NO+H_2O$
- oxidací oxidu dusitého vzniká znovu oxid dusičitý, který vstupuje zpět do reakce
- $2\ NO+O_2\longrightarrow{2}\ NO_2$
- $R\cdot+HNO_3\longrightarrow{R-NO_2}+\cdot{OH}$
- $RH+\cdot{OH}\longrightarrow{R\cdot}+H_2O$
- produktem nitrace jsou směsi izomerních nitrosloučenin
- dochází také ke štěpení uhlíkatého řetězce a vzniku dalších nitroderivátů
- jednotlivé produkty od sebe lze oddělit destilací
Sulfochlorace
- vodík se nahrazuje skupinou $-SO_2Cl$
- vzniká alkansulfonylchlorid
- reakce je iniciována UV zářením
- při propagaci vzniká reakcí alkylového radikálu s oxidem siřičitým ke vzniku alkansulfonylového radikálu ($RSO_2\cdot$)
- při terminaci zanikají radikály
Eliminační reakce
Dehydrogenace
- eliminace vodíku $H_2$
- probíhá za přítomnosti katalizátoru ($Ni$ nebo $Pt$) při teplotách 200 - 400 °C
- vznikají nenasycené uhlovodíky
- $R-CH_2-CH_3\stackrel{Al_2O_3}{\longrightarrow}R-CH=CH_2+H_2$
Termolýza - krakování
- homolytické štěpení vazeb $C-C$
- provádí se za vysoké teploty (termicé krakování) nebo za přítomnosti katalyzátoru (katalitické krakování)
- při reakci není přítomen kyslík
- vzniká směs nasycených a nenasycených uhlovodíků s kratšími řetězci
- využívá se při zpracování ropy
- např.:
- $R-CH_2-CH_2-CH_2-CH_2-CH_3\stackrel{t}{\longrightarrow}R-CH=CH_2+CH_3-CH_2-CH_3$
Izomerace alkanů
- v průběhu vznikají alkany s rozvětveným řetězcem
- probíhá při teplotách vyšších než 100 °C
- probíhá v přítomnosti halogenalkanů nebo alkoholů a halogenidů hlinitých
- Mechanismus izomerace
- zahájením je odtržení chloridového aniontu z molekuly halogenalkanu prostřednictvím Lewisovy kyseliny
- $R-Cl+AlCl_3\longrightarrow{R^+}+[AlCl_4]^-$
- vzniklý kation $R^+$ reaguje s molekulou původního alkanu za vzniku nového kationtu
- tento kation izomeruje neustále dokola odtrhnutím hydridového aniontu
- smísením nového kationtu s molekulou původního alkanu vzniká stabilní rozvětvený alkan a další kation
- používá se při úpravách produktů zpracování ropy
Oxidace
- Prudká oxidace (hoření)
- exotermický děj
- je to radikálová reakce
- kyslík se chová jako biradikál
- úplná oxidace - hoření
- vzniká oxid uhličitý a voda
- $CH_4+2\ O_2\longrightarrow{CO_2}+2\ H_2O$
- neúplná oxidace - nedokonalé hoření
- vzniká oxid uhelnatý nebo uhlík v podobě sazí a voda
- $CH_4+O_2\longrightarrow{C}+2\ H_2O$
- $CH_4+\frac{3}{2}\ O_2\longrightarrow{CO}+2\ H_2O$
- Mírná oxidace
- vznikají kyslíkaté deriváty
Příprava a výroba alkanů a cykloalkanů
Katalytická hydrogenace
- je to jedna z nejpoužívanějších redukčních metod
- je založena na působení molekuly vodíku na původní látku nebo její roztok v prostředí s katalyzátorem
- katalyzátorem je nejčastěji kovy nebo směsi oxidů
- kovy jsou speciálně upravovány
- Raneyův nikl
- vzniká rozkladem slitiny hliníku a niklu alkalickým hydroxidem
- na vzduchu je samozápalný
- může být uchován pod rozpouštědlem, ve kterém bude reakce probíhat
- má radikálový mechanismus
- alkany se připravují katalytickou hydrogenací nenasycených uhlovodíků
- dají se připravit i hydrogenací nižších cykloalkanů
- cykloalkany se získávají katalytickou hydrogenací aromatických uhlovodíků
Výroba benzínu
- katalytická hydrogenace se používá při výrobě syntetického benzínu
- prvním způsobem je vysokotlaká hydrogenace hnědouhelného dehetu
- vzniká benzín o oktanovém čísle 75 až 80
- druhým způsobem je hydrogenace vodního plynu
- vodní plyn je směs oxidu uhelnatého a vodíkového plynu
- probíhá př teplotách nad 200 °C
- vzniká benzín o nízkém oktanovém čísle
- musí se dále upravit
- do spalovacích motorů je nevhodný pro přítomnost nečistot
- jako kov se většinou používá zinek
- používá se v laboratořích
- probíhá v kyselém prostředí
- vznikají alkany a anorganické soli
- výroba alkanů
- $2\ R-X+Zn+2\ H^+\longrightarrow{R-H}+ZnX_2$
- výroba cykloalkanů
- používají se dihalogenderiváty
- např.:
- $CH_2Cl-CH_2-CH_2Cl+Zn\longrightarrow{\textit{cyklopropan}}+ZnCl_2$
Dekarboxylace solí karboxylových kyselin
- provádí se termickým rozkladem soli kyseliny s alkalickým hydroxidem
- vzniká alkan a sůl kyseliny uhličité
- $R-COOM+MOH\stackrel{t}{\longrightarrow}R-H+M_2CO_3$
Zástupci
Methan
- $CH_4$
- je to nejjednodušší alkan
- tvoří podstatnou část zemního plynu a je rozpuštěn v ropě
- nachází se i v bahením plynu a sopečných plynech a v plynech střev přežvýkavců
- na vzduchu hoří modrým plamenem
- je produktem lidské činnosti
- vzniká v laboratoři reakcí trikarbidu tetrahlinitého s vodou
- $Al_4C_3+12\ H_2O\longrightarrow{3\ CH_4}+4\ Al(OH)_3$
- lze ho připravit reakcí natrium-acetátu s hydroxidem sodným
- $CH_3-COONa+NaOH\longrightarrow{CH_4}+Na_2CO_3$
- jeho spalováním za nedostatečného přístupu kyslíku vznikají saze
- částečnou oxidací vodní párou vzniká ethyn
- směs methanu s kyslíkem a amoniakem reaguje za vzniku kyanovodíku a vody
- $2\ CH_4+3\ O_2+2\ NH_3\longrightarrow{2\ HCN}+6\ H_2O$
- kyanovodík se pak používá při průmyslové výrobě akrylonitrilu
- ten slouží k výrobě polymerových vláken
- tato reake pravděpodobně probíhala blízko po zrodu a při ochlazování naší planety
Ethan
- $C_2H_6$
- v menším množství se vyskytuje v zemním plynu a ropě
- laboratorně se připravuje dekarboxylací natrium-propionátu nebo reakcí jodmethanu se sodíkem
- průmyslově se vyrábí katalitickou hydrogenací ethenu
- je významný pro výrobu dalších organických látek
Propan a butan
- $C_3H_8$ a $C_4H_{10}$
- jsou v malém množství obsaženy v zemním plynu a ropě
- jsou odpadem při výrobě syntetického benzínu
- dají se lehce skapalnit a tvoří hořlavou směs
- jejich směs, propanbutan, se používá v domácnostech jako pohoná hmota hořáků a jednoduchých motorů
- vyrábí se z nich nenasycené uhlovodíky
Kapalné alkany
- jsou součástí kapalných paliv a pohonných hmot
- získávají se v průběhu zpracování ropy
Pevné alkany
- jsou obsaženy ve vazelínách a mazacích olejích
Pevné alkany
- jsou obsaženy ve vazelínách a mazacích olejích






