Poznámky
• Chemie • Periodická tabulka • Anorganická chemie • Obecná anorganická chemie • Organická chemie • Obecná organická chemie • Základy společenských věd Chrom
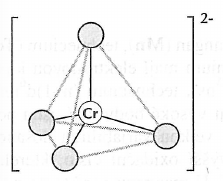
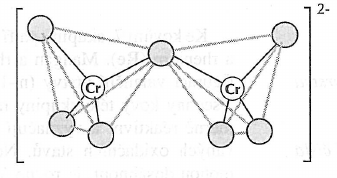
nachází se ve skupuně VI.B jeho elektronová konfigurace je $Ar]3d^54s^1$[* název pochází z řeckého chroma znamená to barva sloučeniny chromu jsou barevné Zisk a výskyt chromu je to v přírodě hojně zastoupený prvek vyskytuje se přibližně ve stejném množství jako nikl jeho nejvýznamnějšími rudami jsou:chromit $FeCr_2O_4$krokoit $PbCrO_4$ stopová množství chromu se nachází v drahých kamenech smaragdu a rubínu jeho naleziště se rychle vyčerpávají a je snaha o jeho postupné nahrazování dostupnějšími materiály je to mikrobiogenní prvek je nezbytný pro metabolismus cukrů jeho fungování není doposud přesně popsáno Vlastnoti chromu na vzduchu je stálýpasivuje se vrstvičkou oxidu používá se proto ke galvanickému pokovování dobře reaguje se žředěnou kyselinou chorovodíkovou a sírovou při styku s taveninami hydroxidů za přítomnosti vzdušného kyslíku tvoří chromany používá se na výrobu slitin s neželeznými kovy a k potírání kovových součástek Vazebné možosti chromu chrom nabývá oxidačních čísel v rozmezí $-II$ až $VI$nejstabilnější je v oxidačním stavu $III$ a $VI$stav $III$ je nejstálejší za nepřítomnosti redukovatelných látek je stálý i stav $II$na vzduchu se okamžitě oxidujístálý je pouze octan ve formě dimeru v nižších oxidačních stavech (do $I$) se vyskytuje v koordinačních sloučeninách atomy $Cr^{VI}$ vykazují výlučeně tetraedrickou nebo deformovaně tetraedrickou koordiancihybridizace $sd^3$na $\sigma$-vazbách se podílejí elektrony z orbitalu $4s$ a tří degenerovaných orbitalů $3d$ na slabé $\pi$-interakci se podílejí i orbitaly $4p$ atomy $Cr^{III}$ vykazují výlučně oktaedrickou nebo deformovaně okaedrickou koordinacisnadno tvoří polyjaderné hydroxokomplexyděje se to kvůli acidobazickému chování iontu $[Cr(H_2O)_6]^{3+}$ion disociuje za vzniku $[Cr(H_2O)_5OH]^{2+}$ v druhém kroku dojde ke spojení dvou těchto částic $[(H_2O)_5Cr-OH-Cr(H_2O)_5]^{5+}$ tvorba hydroxomůstku je typická i pro amminkomplexypůsobením hydroxidu se lomený hydroxomůstek mění na lineární oxomůstekje to reverzibilní změna je doprovázena změnou barvy atomy v ostatních oxidačních stavech vykazují primárně tetraedrickou nebo oktaedrickou koordinaciexistují i jiné možné koordinace Sloučeniny chromu oxid chromitý $Cr_2O_3$je to amfoterní látka ve vodě se nerozpouští má zelenou barvu pokud je vyžíhán, nereaguje s kyselinami je redxně indiferentní používá se jako pigment příprava:termickým rozkladem dichromanu amonného $(NH_4)_2Cr_2O_7$$(NH_4)_2Cr_2O_7\longrightarrow{Cr_2O_3+N_2+4\ H_2O}$ redukcí dochrimanu sodného $Na_2Cr_2O_7$ sírou$Na_2Cr_2O_7+S\longrightarrow{Cr_2O_3+Na_2SO_4}$ oxid chromový $CrO_3$je kyselinotvornýs vodou reaguje za vzniku kyseliny chromové $H_2CrO_4$ má kovalentní charakter připravuje se reakcí koncentrované kyseliny sírové s nasyceným roztokem chromanu draselného $K_2Cr_2O_7$$K_2Cr_2O_7+2\ H_2SO_4\longrightarrow{2\ CrO_3+2\ KHSO_4+H_2O}$ je to velmi dobré oxidační činidlos některými látkami je oxiduje explozivně je složkou pokovovacích lázní používá se pro přípravu některých organokovových sloučenin a esterů kyseliny chromové hydroxid chromitý $Cr(OH)_3$je to amfoterní látkase silnými zásadmi poskytuje hydroxochromitany $[Cr(OH)_4]^-$ s kyselinami dává soli chromité chromany $Cr^{VI}$jsou charakteristicky žluté struktura aniontu: chromany alkalických kovů jsou dobře rozpustné ve vodě jsou to velmi dobrá oxidační činidla získávají se neutralizací kyseliny chromové $H_2CrO_4$ nebo oxidací $Cr_2O_3$ v taveninách vzdušným kyslíkem jsou stálé v zásaditém prostředív kyselém prostředí podléha kondenzacinapř.: $2\ CrO_4^{2-}+2\ H_3O^+\longrightarrow{Cr_2O_7^{2-}+3\ H_2O}$ vede k vzniku polychromanových aniontů deriváty chromanůsubstitucí jednoho atomu kyslíku v chromanovém aniontu za chlor vznikají halogenochromany nastává to třeba v molekule chlorochromanu draselného $KCrO_3Cl$ připravují se varem kyseliny chlorovodíkové s dichromanem$K_2Cr_2O_7+2\ HCl\longrightarrow{2\ KCrO_3Cl+H_2O}$ substitucí dvou atomů chlorů vzniká dichlorid-dioxid chromový $Cr_2O_2Cl_2$je to krvavě červená kapalina na vzduchu sublimuje je silně korozivní při styku s kůži způsobuje popáleniny a poškuzuje dýchací cesty při požití způsobí obrovská vnitřní zranění je velmi karcinogenní s vodou reaguje extrémně agresivněpři hoření by se měl kontakt s vodou obejít obdobné sloučeniny obsahující jod nebo brom nelze připravit dichromany $Cr^{VI}$jsou charakteristicky oranžové struktura aniontu: v roztoucích jsou schopny oxidovat železnaté kationty nebo oxid siřičitý na sírany dichroman sodný (dihydrát ) $Na_2Cr_2O_7\cdot{2\ H_2O}$slouží jako výchozí surovina pro výrobu řady pigemntů a nátěrových hmot v organické syntéze se používá jako oxidační činidlo halogenidy připravují se přímým slučováním elementárních prvkůs fluorem poskytuje $CrF_5$ a $CrF_6$ s ostatními halogeny poskytuje $CrX_3$jejich redukcí vznikají $CrX_2$dá se toho dosáhnout proudem vodíku nebo ve vodných roztocích působením práškového chromu nebo zinku halogenidy chromnaté jsou extrémně silná redukční činidlajsou schopny redukovat protony ve vodě na elementární vodík jsou modře zbarvené sulfid chromitý $Cr_2S_3$sulfidy ve vyšších oxidačních stavech nejsou známy připravuje se přímou syntézou známy jsou také karbidy a nitridy chromumají různá oxidační čísla komplexy chrom tvoří nejrozmanitější řadu komplexních sloučenin nejčastěji se v nich chrom vyskytuje v oxidačním stavu $III$ obvyklími ligandy jsou molekuly $H_2O,NH_3$, aminy](/notes/research/chemistry/organic-chemistry/carbohydrate-derivatives/amines), [pyridinu, močoviny a ionty $F^-,Cl^-,Br^-,CN^-,SCN^-,Cr_2O_4^{2-},NO^+$ a další komplexní dodekahydrát síranu draselno-chromitého $[K(H_2O)_6][Cr(H_2O)_6] (SO_4)_2$kamenec chromitý používá se v kožedělném průmyslu k čínění kůže má fialovou barvu organokovové sloučeniny