Uhlík
- nachází se ve skupině IV.A
- jeho elektronová konfigurace je $[He]2s^22p^2$
Zisk a výskyt uhlíku
- v přírodě se vyskytuje jak volný ve formě grafitu a diamantu, tak vázáný v oxidu uhličitém a uhličitanech
- je to základní stavební jednotka živé hmoty
Alotropické modifikace uhlíku
- elementární uhlík se vyskytuje ve třech alotropických modifikacích
Grafit
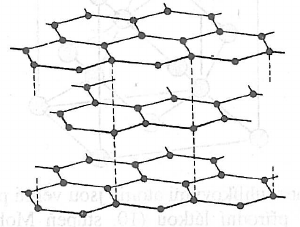
- má vrstevnatou strukturu
- jednotlivé vrstvy obsahují hexagonálně uspořádané atomy uhlíku
- vazba mezi uhlíky je velmi pevná
- vrstvy jsou spolu spojeny rozsáhlým systémem delokalizovaných $\pi$-elektronů
- $\pi$ sysém je přičinou vlastností grafitu
- způsobuje jeho barvu, neprůsvitnost, kovový lesk a elektrickou vodivost
- van der Waalsovy síly poutající vrstvy k sobě umožňují odlamování vrstev
- to umožňuje použití grafitu v tuhách tužek
- při vyšších teplotách reaguje s alkalickými kovy za vzniku sloučenin typu $MC_8$ a $MC_{16}$ a sycením bromovými parami vzniká $C_8Br$
- tyto sloučeniny jsou podobně vodivé jako jiné kovy
- grafit se využívá primárně k výrobě elektrod, žáruvzodrných materiálů, tužek, mazadel a pigmentů
Diamant
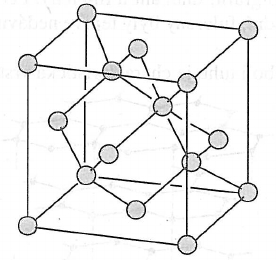
- jeho struktura se skládá z individuálních tetraedrů, které jsou v každém vrcholu spojeny s dlaším tetraedrem
- vazby mezi uhlíky jsou mimořádně pevné
- diamant je nejtvrdší přírodní látkou
- má největší známou tepelnou vodivost
- pro svoji tvrdost nalézá uplatnění v různý řazných a vrutných nástrojích
- díky jeho tepelné vodivost se nepřehřívají
- uplatňuje se také ve šperkařství v nejruznějších broušených variantách
- nejznámnějším brusem diamantu je brilliant

Fullereny
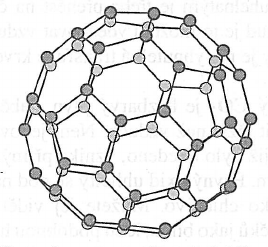
- byla připravena uměle
- získává se odpařováním grafitové elektrody v elektrickém oblouku
- jejich molekuly jsou tvořeny ruzným počtem atomů uhlíku
- u diamantu a grafitu se jedná o polymerná struktury
- byli izolovány molekuly $C_{60}$, $C_{70}$, $C_{80}$, $C_{84}$, $C_{90}$, $C_{94}$ a další
- jejich molekuly mají tvar mnohostěnu
- vazby mezi nimi tvoří tři vazby $\sigma$ a jedna vazba $\pi$
Sloučeniny uhlíku
Sloučeniny uhlíku s kyslíkem
- oxid uhelnatý $CO$
- je to bezbarvý plyn velmi málo rozpustný ve vodě
- připravuje se dehydratací kyseliny mravenčí koncentrovanou kyselinou sírovou
- vzniká při spalování uhlíku za nedostatku kyslíku
- reakce spočívá ve vzniku oxidu uhličitého, který je ihned zredukován nezreagovaným uhlíkem
- $CO+O_2\longrightarrow{CO_2}$
longrightarrow{2\ CO}$
- je velmi reaktivní
- má redukční vlastnosti
- je jedovatý a bez zápachu
- váže se na hemoglobin
- při dostatečně velké kontaminaci těla dochází ke smrti vnitřním udušením
- člověk, který se nadýchal oxidu uhelnatého, musí být přenesen na čerství vzduch a obvykle je nutné podání vzduchu obohaceného kyslíkem
- někdy je nutná transfuze krve
- zablokovaný hemoglobin se neobnovuje
- oxid uhličitý $CO_2$
- je to bezbarví plyn slabě kyselého zápachu
- není jedovatý, ale je nedýchatelný
- hluboký nádech způsobuje úpadek do bezvědomí a následně udušení
- jeho pevná forma se nazývá suchý led
- za normálních teplot sublimuje
- používá se jako chlaidvo
- v kapalné formě se používá jako náplň do sněhových hasicích přístrojů
- kyselina uhličitá $H_2CO_3$
- vzniká rozpouštěním oxidu uhličitého ve vodě
- většina oxidu uhličitého je ovšem přítomna v hydratované formě o stechiometrii $CO_2\cdot{n\ H_2O}$
- z roztoku ji nelze izolovat
- významné jsou její soli
- jsou to buď hydrogenuhličitany nebo uhličitany
- významné jsou zejména hospodářsky
- uhličitan sodný $Na_2CO_3$ - soda
- uhličitan draselný $K_2CO_3$ - potaš
- uhličitan vápenatý $CaCO_3$ - vápenec
- významné jsou i její další deriváty
Sloučeniny uhlíku s vodíkem
- označují se jako uhlovodíky
- je to obrovská skupina látek
- jejich chemií se zabývá obor organické chemie
- jejich zdrojem je primárně ropa
Sloučeniny uhlíku s halogeny
- jedná se o velkou skupinu látek
- některé jsou jedovaté nebo škodí životnímu prostředí
- chlorid uhličitý $CCl_4$
- je to jedovatá, karcinogenní látka nasládlého zápachu
- dříve se používá do hasících přístrojů, ale postupně se pro svou jedovatost odstraňuje
- freony
Karbidy
- jsou to binární sloučeniny uhlíku s elektropozitivnějšími prvky
- přípravují se reakcí uhlíku s kovy nebo jejich oxidy při vysokých teplotách
Iontové karbidy (acetylidy)
- jsou to soli ethynu
- ve struktuře obsahují ionty $C_2^{2-}$
- patří sem primárně karbidy alkalických kovů a kovů alkalických zemin
- karbidy alkalických kovů se obvykle připravují reakcí ethynu s roztokem kovu v amoniaku
- s vodou reagují za vývoje ethynu
- karbid vápenatý $CaC_2$
- varábí se reakcí oxidu vápenatého s koksem v elektrické peci
- jeho reakce s vodou se dříve využívala k průmyslové výrobě ethynu
- dnes se využívá k syntéze kaynamidu vápenatého $CaCN_2$
- karbidy stříbrný, zlatný a měďný jsou výbušné
Intersticiální karbidy
- mají atomy uhlíku umístěné v mezerách krystalových mřížek kovů
- poloměr atomu kovu musí být alespoň 135 pm
- jsou žáruvzdorné, extrémně tvrdé a zachovávají si některé původní vlastnosti kovu
- karbid wolframu $WC$
- používá se k výrobě rychlořezných nástrojů
Karbidy prvků skupiny železa
- $Cr_3C_2$, $Mn_3C$, $Fe_3C$, $Co_3C$ a $Ni_3C$
- jsou přechodem mezi iontovými a intersticiálními karbidy
- se struktuře obsahují uhlíkové řetězce v krystalické mřížce kovu
- s vodou reagují za vzniku uhlovodíků a vodíku
Kovalentní karbidy
- $Be_2C$, $Al_4C_3$, $SiC$, $B_4C$
- tvoří trojrozměrné atomové mřížky
- připravují se reakcí prvku nebo jeho oxidu s uhlíkem
- $Be_2C$ a $Al_4C_3$ reagují s vodou za vzniku methanu
- $SiC$ a $B_4C$ jsou chemicky velmi odolné a mimořádně tvrdé
Kynovodík $HCN$
- je to bezbarvá kapalina s bodem varu 25.6°C
- tvoří lineární molekuly $H-C\equiv{N}$
- bez přítomnosti stabilizátoru polymeruje
- vyrábí se reakcí methanu s amoniakem za vysoké teploty a přítomnosti katalyzátoru ve formě platiny
- je výborným rozpouštědlem elektrolytů
- dobře se rozpouští ve vodě
- je prudce jedovatý
- způsobuje ochrnutí dychácího centra nervové soustavy
- je důležitou surovinou pro výrobu dalších látek



