Poznámky
• Chemie • Periodická tabulka • Anorganická chemie • Obecná anorganická chemie • Organická chemie • Obecná organická chemie • Základy společenských věd Organokovové sloučeniny
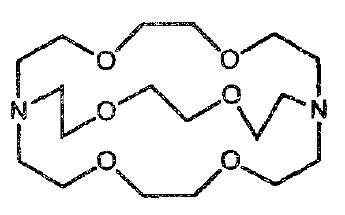
jsou to organické sloučeniny, ve kterých se nachází vazba uhlík-kovdo skupiny nepatří jednodušší sloučeniny jako kyanidy a karbidy používají se v organické syntézejsou velmi reaktivní a umožňují tak řadu chemických přeměn, které by nebyly možné s použitím standardních látek jsou to sloučeniny, které obsahují vazby uhlíku s kovy hlavních skupin, kam se řadí i skupina zinku hodně se podobají odpovídajícím sloučeninám s vodíkemelektronegativita uhlíku a vodíku je dost podobná vazba je většinou iontová nebo silně polárníelektronegativita nepřechodných kovů je totiž nižší než uhlík kladný parciální náboj je na kovu na uhlíku je záporný parciální náboj stálost se zvyšuje s rostoucí elektronegativitoutakové vazby mají kovalentní charakter pozorujeme to u sloučenin prvků 4. a 5. skupiny vaužívá se toho v přípravě celé řady organometalických sloučenin$M-R+E-X\longrightarrow{MX+R-E}$$M$ - $Li,Mg,Al,Zn$ $E$ - $Si,B,As,P$ iontovost vazby $C-M$ je okolo 50%špatně se znázorňuje vazba mezi uhlíkem kovem pomocí čárky vazba je také nejvíce polární ze všech sloučenin lze je připravit reakcí elementárního kovu a příslušného uhlovodíku prudce reagují s vodou nejstálejší jsou organolithné sloučeniny lithiapoužívjí se v organické syntézeběžně se používá buthyllithium a fenyllithium připravují se reakcí kovu s alkyl- nebo arylhalogenidem jsou oligomerní ostatní sloučeniny jsou na vzduchu nestálé a samozápalné existují sloučeniny, kde se nachází sodný kation jako centrální atom koordinační sloučeninyk roztoku kovového iontu se přidávají sloučeniny obsahující karbonylové skupiny nebo polyetherykovový kation interguje s kyslíkovými atomy a vzniká komplexní částice smíšený komplex salicyladehydu a 2-nitrofenolu 18-crown-6 2,2,2-kryptand Organokovové sloučeniny prvků 2. skupiny nejznámější jsou sloučeniny beryllia a hořčíku oba kovy tvoří polymerní methyl derivát s analogickou strukturou jejich hydridů Grignardova činidla organohořečnaté sloučeniny (alkylmagnesiumhalogenidy ) obecný vzorec: $RMgX$ např.: $CH_2CH_2MgI$ - ethylmagnesiumjodid připravují se rakcí halogenovaných uhlovodíků s práškovým hořčíkem v etherickém roztoku používají se jako alkylační činidla byli objeveny francouzským chemikem V. Grignardem získal za ně Nobelovu cenu v roce 1912 organokovové sloučeniny kovů alkalických zemin jsou velmi nestálé tvoří lineární molekuly $MR_2$nejsou asociovány v pevné fázi ani roztokunetvoří se alkylové můstky dimethylrtuť $Hg(CH_3)_2$je to extrémně toxická kapalina ma bod varu blízký vodě s vodou se misí ve vodách vzniká působením mikroorganismů z nerozpustných produktů rozpadu organortuťnatých fungicidů její reakce s halogenidy kovů je důležitá pro koncept Lewisových tvrdých a měkkých kyselin$n\ Hg(CH_3)_2+2\ MX_n\longrightarrow{n\ HgX_2+2\ M(CH_3)_n}$ tato reakce probíhá, pokud kov $M$ tvoří silnější kovalentní vazbu než rtuť měkké kyseliny vytěsní rtuťtvrdé kyseliny rtuť nevytěsní zinek tvoří také sloučeniny typu $RZnY$$Y$ - halogen, kyanoskupina nebo skupiny typu $OR,SR,NR_2,PR_2$ a další uplatňují se jako výchozí látky pro polymeraci do komplexů se často váže thiomočovina, aminy , $CH_3COO^-$ a další organické sloučeniny kadmium nemá jiné běžné sloučeninyrtuť tvoří látky typu $RHgY$ $Y$ značí velkou skupinu různých atomových uskupení některé se používají ve farmacii Organokovové sloučeniny prvků 3. skupiny nejrozsáhlejší je skupina sloučenin tvoří bor jedná se o analoga boranů hliník tvoří sloučeniny typu $R_3Al,R_2AlY,RAlY_2$$R$ - alkyl nebo aryl $Y$ - $H,F,Cl,Br,I,OR,CN,PR_2$ jsou většinou dimerní a elektronově deficitní mají stejné uspořádání jako chlorid hlinitý $M[AlR_4]$$M$ - alkalický kov $R$ - alkyl, $H,OR$ jejich struktura je iontová mají silné redukční účinky některé jsou samozápalné využívají se v organické syntéze a katalýze a v raketové technice ostatní prvky prvky tvoří sloučeniny podobné těm hliníkuOrganokovové sloučeniny prvků 4. skupiny jsou to převážně tetraalkylsloučeniny a tetraarylsloučeniny $R_4M$ případně sloučeniny od nich odvozené $R_3MY,R_2MY_2,RMY_3$$Y$ - $H,F,Cl,Br,I,OH,OR,CN,NCO,NCS,CNS,\frac{1}{2}S,SiR_2,OSiR_3,\frac{1}{3}N,NR_3,\frac{1}{2}NH$ většina těchto sloučenin jsou těkavé nízkomolekulární látky nejrozsáhlejší je chemie organosilikonových sloučenin křemík se vlastnostmi uhlíku celkem blíží uhlíku typické je koordinační číslo 4 síla vazby $Si-C$ je o trochu slabší než síla vazby $C-C$, kvůli její slabé polaritězpůsobuje to snadnější nukleofilní ataku nejsnáze se tvoří methyl deriváty reakcí chlor methanu s křemíkem při teplotě 300°C a za katalýzy mědí vznikají sloučeniny typu $(CH_3)_nSiCl_4-n$jejich hydrolýzou se vyrábí siloxany slouží pro výrobu dalších derivátů$2\ (CH_3)_3SiCl+2\ Li\longrightarrow{(CH_3)_3Si-Si(CH_3)_3+2\ LiCl}$ změnou reakčních podmínek se dají připravit velmi rozmanité deriváty sloučeniny germania jsou analogické těm křemíku sloučeniny cínu jsou méně rozmanitémají většinou vyšší koordinační číslo než 4třeba dufluor-dimethylstannan $SnF_2(CH_3)_2$ má polymerní strukturu s koordinačním číslem 6ostatní halogenidy poskytují monomerní sloučeniny typu $(CH_3)_2SnX_2$ takové sloučeniny reagují s vodou za vzniku kationtů typu $R_2Sn(H_2O)_4^{2+}$ existují sloučeniny s vazbou kov-kov$Sn_4F_5(CH_3)_{12}$ $Sn_5(CH_3)_{10}$ $Sn_5(C_6H_5)_{12}$ olovo poskytuje malý počet sloučenin$(C_2H_5)_4Pb$ - tetraethylplmbum používala se jako přídavek do benzínu jako antidetonační přísadauvolňuje se do vzduchu a znečičťuje životní prostředí olovo se usazuje v minerálech olovo se ze vzduchu dostává do lidského tělausazuje se v kostech způsobuje snižování inteligence a pravděpodobně způsobylo nárůst kriminality je prudce jedovaté Organokovové sloučeniny prvků 5. skupiny připravují se reakcí halogenidů typu $EX_3$ nebo oxihalogenidů typu $EX_3O$ s Grignardovými činidly fosfor nejvýznamější jsou trialkyl- a triarylfosfiny $R_3P$s rostoucím řetězcem je stálost větší trimethylfosfin $(CH_3)_3P$ je na vzduchu nestálý a samozápalnýtrifenylfosfin $Ph_3P$ je stálývyrábí se průmyslově je významným ligandem komplexních sloučenin některých přechodných kovů jeho oxidací peroxidem vodíku vzniká trifenylfosfinoxid dá se připravit i reakcí chloriduoxidufosforečného s Grignardovým činidlem mají schopnost vytvářet fosfoniový kation $PH_4^+$ fosfor může s uhlíkem vytvářet dvojnou vazbu za vzniku alkylidenfosforanů v nižších oxokyselinách fosforu, $HPO_2$ a $H_3PO_3$, lze vodíky substituovat za alkyly na kyseliny fosfinové $R-P(H)O_2H$ a $R-P(R’)O_2H$ a fosfonové $R-PO_3H_2$jejich aminoderiváty a jejich deriváty byli pozorovány v živých organismech ostatní pentely tvoří obrovskou skupinuexistuje celá řada jsou to:molekulární látky $R_3M,R_2MY$ a $RMY_2$ oniové soli $[R_4M]^+\ Y^-$ a $[R_3HM]^+\ Y^-$jsou to analoga amonných a fosfoniových solí s vazbou kov-kov arseničné a antimoničné sloučeniny $R_5M,R_4MY,R_3MY_2,R_2MY_3$ a $RMY_4$ Příprava organokovových sloučenin prvků hlavních skupin nejběžnější metodou přípravy je přímá reakce kovu s alkylhalogenidemkov i alkylhalogenid jsou umístěny ve vhodném rozpouštědlealkylfluoridy se většinou nepoužívají, protože jsou málo reaktivní a málo dostupné u lithia se nejčastěji používá diethylether nebo nasycený uhlovodík produktem je alkyllithium a halogenid lithia u hořčíku se používají výhradně ethery produktem je alkylmagnesiumhalogenid ethery stabilizují vzniklé grignardovo činidlo vytvořením komplexu Lewisova kyselina-Lewisova báze ethery navíc obnovují povrch hořčíku, tekže umožňují rekaci pokračovat s reaktivnějšími arylhalogenidy](/notes/research/chemistry/organic-chemistry/carbohydrates/arenes) a [vinylhalogenidy se jako rozpouštědlo používá tetrahydrofuran u zinku se používají také téměř výhradně etheryproduktem alkylzinkhalogenid k reakci dochází na povrchu kovuprvní krokem je předání nepárového elektronu kovu alkylhalogenidu a vzniká radikálanion$R-X+M\cdot\longrightarrow[R-X]^-+M^+$ v dalším kroku se radikálanion rozpadá na halogenidový anion a alkylový radikál alkylový radikál je rychle zachycen kovovým radikálem a vzniká alkylkov kovový kation a halogenidový anion potom spolu vytvoří příslušný halogenid pro přípravu organických sloučenin s méně elektropozitivními prvky se používají alkylkovy připravené přímou reakcí a halogenidy příslušných prvkůtransmetalace je to přenos organického zbytku z jedné sloučeniny na druhou Reakce organokovových sloučenin prvků hlavních skupin jsou to velmi silné bázedokáží odtrhnout protony i z velmi málo kyslích sloučenin mohou reagovat jako jako nukleofilní činidla nejreaktivnější jsou organolithné a organohořečnaté sloučeninymají největší polaritu vazby uhlík-kov organokovové sloučeniny prvků s nižší elektropozitivitou reagují s vodou a slabými kyselinami jen velmi neochotnědůsledkem toho je, že dlouho strvávají v životním prostředí a mohou působit ekologickou zátěž jsou to sloučeniny, které obsahují vazbu mezi uhlíkem a přechodným kovem vyčleňovány jsou kyanidy a jejich deriváty a částečně také karbonylyorganoemtalické a koordinační sloučeniny se do značné míry překrývají hapticita $\eta$koordinace prostřednictvím $\pi$ vazeb udává počet atomů uhlíku ve vazebné vzdálenosti k centrálnímu atomumonohapto $\eta^1$vyskytuje se třeba u methylového ligandu dihapto $\eta^2$vyskytuje se v ethenylovém ligandu pentahapto $\eta^5$vyskytuje se cyklopentadienylového ligandu Lewisova teorie měkkých a tvrdých kyselin ochota tvořit organometalické sloučeniny je u měkkých kyselin většítvoří snadno kovalentní vazby sloučeniny měkkých kyselin jsou mnohem stálejší tyto prvky tvoří kationty $M^{3+}$ patří do skupiny tvrdých kyselin jejic sloučeniny $MR_3$ jsou na vzduchu nestálésnadno se oxidují i hydrolyzují výjimku tvoří cyklopentadienyly $[M(C_5H_5)_3]$převládá iontový charakter vazby mezi centrálním atomem a anionty $C_5H_5^-$ připomínají sloučeniny skandia, yttria, a lanthanu tetraalkyly $MR_4$ jsou velmi nestálé$Ti(CH_3)_4$ se rozkládá nad teplotou -20°C titan sloučeniny typu $R_4Ti$ ($R_3TiY,R_2TiY_2,RTiY_3$) jsou nejstálejší sloučeniny typu $R_3Ti$ ($R_2TiY,RTiY_2$) a $R_2Ti$ ($RTiY$) jsou mnohem méně stálé jsou extrémně snadno hydrolyzovatelné na vazbě $Ti-C$ na vzduchu se sloučeniny obsahující atomy titian v oxidační stavu méně než $IV$ velmi rychle oxidují velký výnam má intermediární tvorba vazeb $Ti-C$ při Ziegler-Nattově katalyzované polymeraci alkenůje to děj, při němž do vazby $Ti-C$ neustále vstupují nové a nové molekuly ethenu, za vzniku rozsáhého uhlíkatého řetězce používá se směs $R_3Al$ a $TiCl_4$ reakcí $TiCl_4$ s $NaC_5H_5$ se dá přípravit $[Ti(\eta^5-C_5H_5)_2]Cl_2$ zirkonium a hafnium vazba kov-uhlík je docela slabá na vzduchu jsou poměrně stálé komplexy typu $[M(\eta^5-C_5H_5)_2]X_2$ vanad nejvýznamnější jsou:karbonyly $[V^{-I}(CO)_6]$cyklopentdieny s nespecifikovanými donorovými atomy uhlíku $[(\eta^5-C_5H_5)_2V]$ (vanadocen )přpadně deriváty $[(\eta^5-C_5H_5)_2VY]$ a $[(\eta^5-C_5H_5)VY_2]$ jsou poměrně nestálé některé se uplatňují při katalytické kopolymeraci směsi alkanů niob a tantal anallogické sloučeniny netvořínejsou příliš prozkoumané studovány byli některé karbonyly, cyklopentadieny a alkylkovy chrom významné jsou estery $H_2CrO_4$používají v katalytické chemii a organické syntéze karbonyly známé jsou hexakarbonyl chromu $[Cr(CO)_6]$ a jeho deriváty$[Cr(CO)_5Y],[Cr(CO)_4Y_2],[Cr(CO)_3Y_3],[Cr(CO)_2Y_4],[Cr(CO)Y_5]$$Y$ - $CN^-,SCN^-,NCS^-,Cl^-,Br^-,I^-,PR_3,NH_3$ a další haptické sloučeniny bis( $\eta^6$-beznen)chrom $[(\eta^6-C_6H_6)_2Cr]$chromocen $[(\eta^5-C_5H_5)_2Cr]$používá se v katalytické chemii a organické syntéze byli připraveny i další smíšené sloučeniny$[(\eta^5-C_5H_5)Cr(CO)_3H],[(\eta^5-C_5H_5)Cr(CO)_3]$ a jiné molybden významné jsou karbonyly a jejich deriváty dále je schopen tvořít vazby s anionty $C_5H_5^-,$ borany, karborany a alkyly a aryly vyskytují se v nich často vazby kov-kov a kov-halogen wolfram nemá příliš velkou tendenci tvořit organokovové sloučeniny hexamethylwolfram $W(CH_3)_6$ je tmavě červená krystalická látkapro molybden a wolfram není typická tvorba metalocenůvytváří se pouze dimery $[M(\eta^5-C_5H_5)(CO)_3]$ stabilnější jsou sandwichové sloučeniny $[M(\eta^6-C_6H_6)_2]$ stálostí se docela podobají sloučeninám chromu, molybdenu a wolframu z metalocenů je znám pouze manganocen $Mn(\eta^5-C_5H_5)$ mangan vazby $Mn-C$ tvoří velmi neochotně základní organokovové sloučeniny jsou velmi nestálé krom derivátů karbonylu manganu jsou významné i sloučeniny typu $RMnY,MnR_2,MnR_3$ a $M^IMnR_3$ dalé mangan tvoří sloučeniny s nepřesně definovanými vazbami, primárně acetylidy a allylidy ((prop-2-en)yly ) rhenium vazby $Re-C$ tvoří vcelku ochotně jeho sloučeniny jsou mnohem stálejší stabilitu zvyšuje přítomnost atomů kyslíku celá řada sloučenin se odvozuje od $Re_3Cl_9$ substitucí atomů chloruextrémem jsou sloučeniny typu $Re_3R_9$ Organokovové sloučeniny prvků triády železa $\sigma$-vazby s uhlíkem tvoří velmi neochotně doposud nebyly připraveny jednoduché sloučeniny vytváří celou řadu karbonylů železo kromě klasických organokovových sloučeniy se $\sigma$-vazbou typu $Fe-C$, derivátů karbonylů a odbobných látek existuje i mnoho látek s nespecifickou vazbou mezi atomy uhlíku a železem nejvýznamnější je bis( $\eta^5$-cyklopentadienyl)železo (ferrocen , $[Fe(\eta^5-C_5H_5)_2]$) a látky od něj odvozenémolekula je tvořená dvěma planárními cyklopentadienidovými ionty ležících ve dvou rovnoběžných rovinách a uzavírají mezi sebou kation $Fe^{2+}$ má podobné chemické vlastnsoti jako jiné aromatické sloučeniny jednotlivé vodíky obou cyklopentadienových kruhů je možné nahradit dalšími substituenty cyklopentadienové kruhy je možné nahradit jiným aromátem železo se dá oxidovat a vzniká ferriciniový kation $[Fe(\eta^5-C_5H_5)_2]^+$ jeho reakcí s $Fe(CO)_5$ se získává dimerní $[Fe(\eta^5-C_5H_5)(CO)_2]_2$ další organokovové sloučeniny železa se uplatňují v organické katalýze kobalt obsahují $\sigma$-vazby $C-Co$ i nespecifikované vazby a donorové atomy analogem ferrocenu je kobaltocen $[Co(\eta^5-C_5H_5)_2]$je paramagnetický na vzduchu se oxiduje na kation kobalticenia $[Co(\eta^5-C_5H_5)_2]^+$je stálý a odolný vůči působení koncentrované $HNO_3$ existuje mnoho dalších sloučenin obsahujících jako ligandy aromatické molekuly , allylová skupina, molekuly dienů a podobně nikl tvoří je velmi podobně jako kobalt a železomohou také obsahovat $\sigma$-vazby $C-Ni$ nebo donorově nespecifikované vazby analogem ferrocenu je nikelocen $[Ni(\eta^5-C_5H_5)_2]$ dále tvoří komplexy s alkeny](/notes/research/chemistry/organic-chemistry/carbohydrates/alkenes,-polyenes-and-cycloalkenes), alkyny , allylovou skupinou, [pyridinem, thiomočovinou $CS(NH_2)_2$ a řadou dalších organických látek netvoří jednoduché sloučeniny se $\sigma$-vazbou ke stabilizaci je potřeba koordinace ligandů $\pi$-vazbami a karbonylovými skupinami oba kovy vytváří vazby kov-kovtím vzniká rozsáhlá skupina karbonylů a klastrů a jejich derivátů známé jsou sloučeniny:$Os_3(CO)_{12}$ $Os_6(CO)_{12}$ mají velký význam pro katalýzu v mnohém se podobají sloučeninám lehkých platinových kovů tvoří velmi rozsáhlou skupinu klastrových karbonylů a jejich derivátů s vazbami kov-kovexistují sloučeniny typu $M_6(CO)_6$ jednoduché sloučeniny se $\sigma$-vazbami jsou velmi málo běžné a jednoduché karbonyly neexistují karbonyly musí být stabilizovány dalšími ligandy mnohem častější jsou sloučeniny s nespecifikovanými ligandy, jako jsou ethen, dieny](/notes/research/chemistry/organic-chemistry/carbohydrates/alkenes,-polyenes-and-cycloalkenes), alkyny , karbonyl, substituovaný fosfan nebo arsan, ale také [pyridin a aminy chemie organometalických sloučeniny je vlastně málo rozsáhlá jednoduché karbonyly neexistují alkylové sloučeniny jsou málo časté a většinou nestálé měď nejsou příliš typické v některých komplexech se jako ligandy objevují močovina, thiomočovina, aminy a další alkylové sloučeniny mědi byli objeveny relativně nedávno málo častá je koordinace alkenů a dienů a karbonylu ještě vzácnější jsou donorově nespecifické vazby zlato není jich mnoho nejčastěji obsahují $\sigma$-vazbu $C-Au$ jsou to většinou látky typu $R_2AuY$ a $RAuY_2$$R$ - alkyl $Y$ - halogen, kyanoskupina, hydroxylový skupina většina je dimerní nebo dokonce polymerní stříbro nejsou typické bylo popsáno několik komplexů s alkeny , alkyny a areny jsou to většinou donorově nespicifické sloučeniny
areny